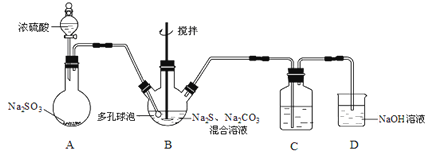
题目内容
【题目】I.生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的原子结构示意图_____________。
(2)根据等电子原理,写出CO分子的结构式____________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是______________________________________。
②甲醛分子的空间构型是____________________;1 mol甲醛分子中σ键的数目为________。
II.在下列物质中:①HCl、②N2、③NH3、④Na2O2、⑤C2H4、⑥NaOH、⑦Ar
(1)只存在极性键的分子是_________;只由非极性键构成的非极性分子是________;(填序号,下同)。
(2)既有非极性键,又有极性键构成的非极性分子是_________。
(3)既有离子键,又有共价键的是________。
【答案】
![]() 甲醇分子间含有氢键 平面三角形 3NA ①③ ② ⑤ ④⑥
甲醇分子间含有氢键 平面三角形 3NA ①③ ② ⑤ ④⑥
【解析】
I.(1)根据锌的原子序数写基态Zn原子的原子结构示意图;
(2)根据CO与N2为等电子体,书写CO的结构式;
(3)①利用氢键来解释物质的沸点;
②利用杂化类型来分析空间结构,并利用判断σ键的规律来分析σ键数目;
II.不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键;正负电荷中心重合的分子为非极性分子;活泼金属和活泼非金属元素之间易形成离子键,据此分析解答。
I.(1)Zn的原子序数为:30,基态Zn原子的原子结构示意图为: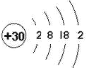 ,故答案为:
,故答案为: ;
;
(2)根据等电子原理,CO与N2为等电子体,N2分子的结构式为:![]() ,互为等电子体的结构相似,则CO分子的结构式为:
,互为等电子体的结构相似,则CO分子的结构式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)①甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高,故答案为:甲醇分子间含有氢键;
②甲醛分子中含有碳氧双键,共有3个σ键,则碳原子轨道的杂化类型为sp2杂化,则分子的空间构型为平面三角形;1mol甲醛分子中含有2mol碳氢σ键,1mol碳氧σ键,故含有σ键的数目为3NA,故答案为:平面三角形;3NA;
II. (1)不同非金属元素之间易形成极性键,所以只存在极性键的是①③;同种非金属元素之间易形成非极性键,正负电荷中心重合的分子为非极性分子,只由非极性键构成的非极性分子为②,故答案为:①③;②;
(2)C2H4的结构式为:![]() ,既有非极性键,又有极性键,且是非极性分子,故答案为:⑤;
,既有非极性键,又有极性键,且是非极性分子,故答案为:⑤;
(3)Na2O2中钠离子与过氧根离子间存在离子键,过氧根离子内氧原子与氧原子之间是非极性共价键;NaOH中钠离子和氢氧根离子之间存在离子键,HO原子之间存在极性共价键,所以Na2O2与NaOH中含有离子键,又含有共价键,故答案为:④⑥。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】锡是大名鼎鼎的“五金”-金、银、铜、铁、锡之一。SnCl4可用作媒染剂,可利用如下图所示装置可以制备SnCl4(部分夹持装置己略去);
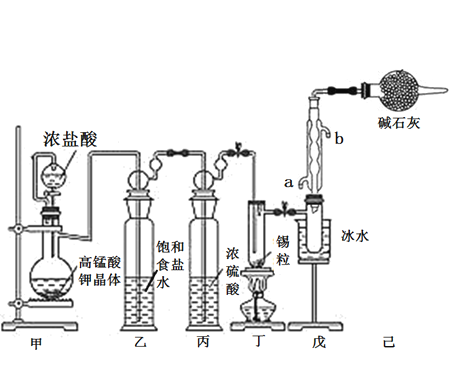
有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)乙中饱和食盐水的作用为___________;戊装置中冷凝管的进水口为________(填“a”或“b”)。
(2)甲装置发生反应的离子方程式为________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到丁装置内充满黄绿色气体后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
①促进氯气与锡反应;
②__________________。
(4)己装置的作用是_______________。
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2的有__________(填标号)。
A.FeCl3溶液(滴有几滴KSCN溶液) B.溴水 C.AgNO3溶液