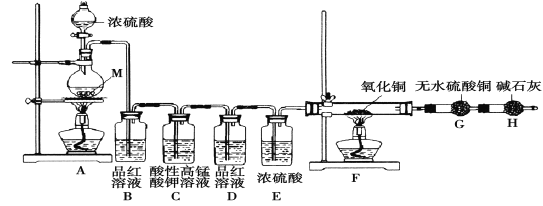
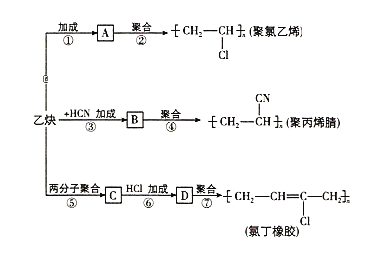
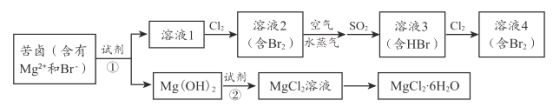
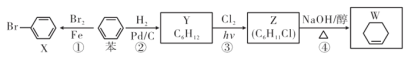
题目内容
【题目】下列有关硅及其化合物的说法正确的是( )
A.陶瓷、玻璃、水泥容器都能贮存氢氟酸
B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在具有磨口玻璃塞的试剂瓶中
C.用![]() 制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通过
制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通过![]()
D.由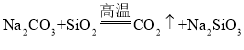 可知,硅酸的酸性强于碳酸
可知,硅酸的酸性强于碳酸
【答案】C
【解析】
A. 陶瓷、玻璃、水泥的主要成分都是硅酸盐,其含有的二氧化硅能与氢氟酸反应,则不能用于贮存氢氟酸,故A错误;
B. 硅酸钠是一种黏合剂,能将玻璃塞和瓶口黏在一起,不便于打开,故B错误;
C.二氧化硅不溶于水,不能与水反应生成硅酸,则用二氧化硅制取硅酸时,应先使二氧化硅与氢氧化钠溶液反应生成硅酸钠,再利用强酸制弱酸的原理,向反应后的溶液中通入二氧化碳制得硅酸,故C正确;
D.二氧化硅的沸点远大于二氧化碳,碳酸钠与二氧化硅高温下反应能发生是因为生成的二氧化碳气体不断逸出,不能说明硅酸的酸性强于碳酸,故D错误;
故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学小组为了探究铝电极在原电池中的作用,进行了下列实验,实验结果记录如下。下列说法正确的是
编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
① | Mg 、 Al | 稀盐酸 | 偏向 Al |
② | Al 、Cu | 稀盐酸 | 偏向 Cu |
③ | Al 、石墨 | 稀盐酸 | 偏向 |
④ | Mg 、Al | NaOH 溶液 | 偏向 Mg |
A.实验①和②中,Al 电极的作用相同
B.实验③中,电流表指针偏向 Al
C.实验④中,Mg 为负极 ,电极反应式为:Mg - 2e-= Mg2+
D.综合以上实验,铝在原电池中的作用 ,与另一个电极材料和电解质溶液有关
【题目】锡是大名鼎鼎的“五金”-金、银、铜、铁、锡之一。SnCl4可用作媒染剂,可利用如下图所示装置可以制备SnCl4(部分夹持装置己略去);
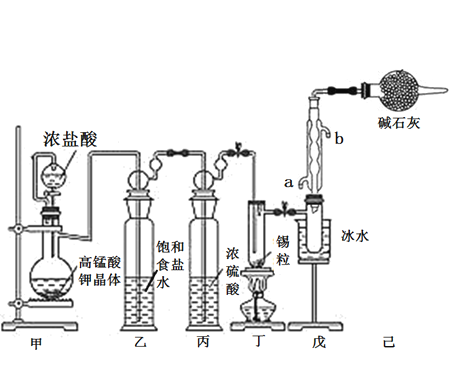
有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)乙中饱和食盐水的作用为___________;戊装置中冷凝管的进水口为________(填“a”或“b”)。
(2)甲装置发生反应的离子方程式为________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到丁装置内充满黄绿色气体后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
①促进氯气与锡反应;
②__________________。
(4)己装置的作用是_______________。
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2的有__________(填标号)。
A.FeCl3溶液(滴有几滴KSCN溶液) B.溴水 C.AgNO3溶液
【题目】A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
A | ||||||
B | C[ | D | ||||
E | F | G | H | |||
请回答下列问题:
(1)写出E元素在周期表中的位置 。
(2)B与D可形成三原子分子X,X的电子式为 。
(3)E、F、H所形成的简单离子的半径由大到小的顺序为 (用离子符号表示)。
(4)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(5)由A、C、D三种元素组成的强电解质Z溶于水时能促进水的电离,测得Z的水溶液pH<7,其原因是 (用离子方程式来表示)。
(6)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如图所示。
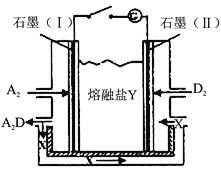
写出石墨(I)电极上发生的电极反应式 。
(7)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为 。