题目内容
14. 自来水生成流程示意图
自来水生成流程示意图(1)混凝剂除去悬浮物质的过程③(填写序号)
①只是物理变化
②只是化学变化
③是物理变化和化学变化
FeSO4.7H2O是常用的混凝剂,它在水中最终生成Fe(OH)3沉淀
(2)实验室过滤操作所用到的玻璃仪器是烧杯、漏斗、玻璃棒
(3)我们有时感觉自来水“有漂白粉气味”是因为使用了氯气消毒,请写出有关的化学反应方程式Cl2+H2O?HCl+HClO下列物质中①③可以作为氯气的代用品(填写序号)
①臭氧②NH2(液)③K2FeO4④SO2
(4)有些地区的天然水中含有较多的钙,镁离子,用离子交换树脂软化硬水时,先后把水通过分别装有阳离子交换树脂和阴离子交换树脂的离子交换柱(填“阴”或“阳”)
(5)测定水中的溶解阳:量取20mL水样,迅速加入MnSO4和KOH混合溶液,再加如Kl溶液,立即塞好塞子,振荡使完全反应,打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成,用0.01mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mLNa2S2O3溶液,已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘单质,本身重新还原为Mn2.上述过程发生的反应可表示为:
2Mn2++4OH-+O=2MnO(OH)2,
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O
I2+2S2O32-=2I-+S4O42-
则水中的溶解氧量为24.0mg•L-1(以mg.L-1为单位)
分析 (1)常用混凝剂为FeSO4•7H2O,被氧化、水解后生成Fe(OH)3;
(2)过滤需要漏斗、烧杯、玻璃棒;
(3)使用了氯气消毒,与水反应生成HCl、HClO;利用其具有强氧化性消毒;
(4)OH-会与钙、镁离子反应生成沉淀,影响阳离子交换树脂发挥作用;
(5)已知:2Mn2++4OH-+O2=2MnO(OH)2、MnO(OH)2+2I-+4H+=I2+Mn2++3H2O、I2+2S2O32-=2I-+S4O62-,可得关系式:O2~4S2O32-,以此计算.
解答 解:(1)亚铁离子不稳定,易被氧化生成铁离子,铁离子水解生成Fe(OH)3胶体,胶体具有吸附性而净水,则发生化学变化和物理变化;FeSO4•7H2O是常用的混凝剂,它在水中最终生成Fe(OH)3沉淀,故答案为:③;Fe(OH)3;
(2)过滤操作使用的玻璃仪器有玻璃棒、漏斗、烧杯等;故答案为:烧杯、漏斗、玻璃棒;
(3)氯气消毒是氯与水反应生成次氯酸消毒,原理是Cl2+H2O?HCl+HClO,臭氧、K2FeO4 具有强氧化性的物质可以代替氯气消毒,
故答案为:Cl2+H2O?HCl+HClO;①③;
(4)通过阴离子交换树脂后生成OH-,OH-会与钙、镁离子反应生成沉淀,影响阳离子交换树脂发挥作用,故先通过阳离子交换树脂再通过阴离子交换树脂,
故答案为:阳; 阴;
(5)已知:2Mn2++4OH-+O2=2MnO(OH)2、MnO(OH)2+2I-+4H+=I2+Mn2++3H2O、I2+2S2O32-=2I-+S4O62-,可得关系式:O2~4S2O32-,
n(S2O32-)=0.01mol/L×0.006L=6×10-5mol,则n(O2)=$\frac{1}{4}$×6×10-5mol=1.5×10-5mol,
m(O2)=1.5×10-5mol×32g/mol=48×10-5g=0.48mg,
则水中的溶解氧量为$\frac{0.48mg}{0.02L}$=24.0mg•L-1,
故答案为:24.0mg•L-1.
点评 本题考查物质的含量测定以及物质的分离、提纯实验方案的设计,为高频考点,侧重分析与应用能力、计算能力的综合考查,注意硬水的软化原理及关系式法在计算中的运用,题目难度中等.

| A. | 还原性强弱:F-<Cl-<I- | B. | 半径K+>Mg2+>Al3+>H+ | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
| A. | 四种元素的原子半径:r(Z)>r(X)>r(Y)>r(W) | |
| B. | X、Y、Z、W形成的单质最多有6种 | |
| C. | 四种元素均可与氢元素形成18电子分子 | |
| D. | 四种元素中.Z的最高价氧化物对应水化物酸化最强 |
| A. | 铝制容器可长期盛放酸性或碱性物质 | |
| B. | 甲烷会导致某些温泉有臭鸡蛋气味 | |
| C. | 太阳能的开发利用可降低碳排放量 | |
| D. | 塑料垃圾会造成水体富营养化 |
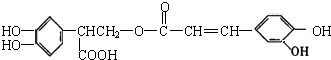
| A. | 迷迭香酸能使酸性高锰酸钾及溴的四氯化碳溶液褪色,属于芳香烃 | |
| B. | 迷迭香酸的分子式为C18H15O8,其在碱性条件下的水解反应叫皂化反应 | |
| C. | 迷迭香酸分子中含有5种官能团 | |
| D. | 1mol迷迭香酸跟H2反应,最多可消耗7molH2 |
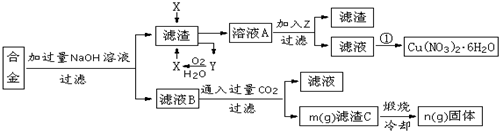
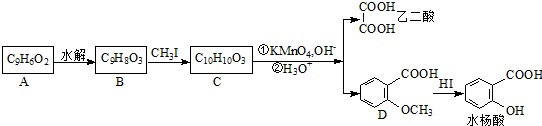
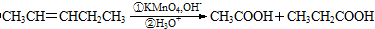
 .
.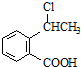 可以最终合成芳香内酯A,其中前两步的反应是
可以最终合成芳香内酯A,其中前两步的反应是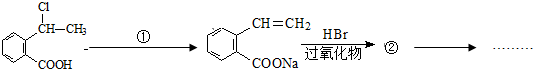
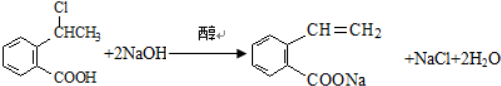 ,产物②的结构简式是
,产物②的结构简式是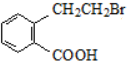 .
.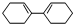 c.
c.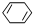 d.
d.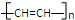
 +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$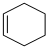 则要制备
则要制备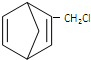 ,含共轭结构的原料可以是
,含共轭结构的原料可以是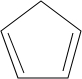 或
或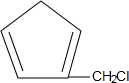 .(写结构简式)
.(写结构简式)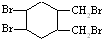 的合成路线(其他无机试剂任选).
的合成路线(其他无机试剂任选).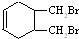 $\stackrel{Br_{2}}{→}$
$\stackrel{Br_{2}}{→}$