题目内容
【题目】恒容条件下,1 mol SiHCl3发生如下反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是
SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是
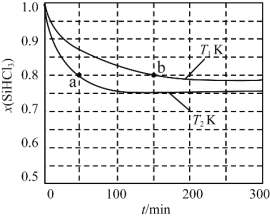
A.该反应为放热反应,v正a<v逆b
B.T1 K时平衡体系中加入Ar气,可使正、逆反应速率均增大
C.当反应进行到a处时,![]() =
=![]()
D.T2 K时平衡体系中再充入1mol SiHCl3,平衡正向移动,x(SiH2Cl2)增大
【答案】C
【解析】
A.由图像可知,T2时先达到平衡状态,对应x(SiHCl3)小,可知升高温度平衡正向移动,则正反应为吸热反应,且v正a>v逆b,A错误;
B.T1 K时平衡体系中加入Ar气,容积为恒容,反应体系中各量的浓度未发生变红,则正、逆反应速率均不变,B错误;
C.2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)反应前后分子数不变,即反应开始至达平衡的过程中混合气体总物质的量始终为1mol,由图像知T2K下达到平衡时SiHCl3的物质的量分数为0.75,则此时SiH2Cl2和SiCl4的物质的量分数均为0.125,因为平衡时v正=v逆,v正=k正x2(SiHCl3)=0.752k正,V逆=k逆x(SiH2Cl2)x(SiCl4)=0.1252k逆,则0.752k正=0.1252k逆,
SiH2Cl2(g)+SiCl4(g)反应前后分子数不变,即反应开始至达平衡的过程中混合气体总物质的量始终为1mol,由图像知T2K下达到平衡时SiHCl3的物质的量分数为0.75,则此时SiH2Cl2和SiCl4的物质的量分数均为0.125,因为平衡时v正=v逆,v正=k正x2(SiHCl3)=0.752k正,V逆=k逆x(SiH2Cl2)x(SiCl4)=0.1252k逆,则0.752k正=0.1252k逆,![]() =
=![]() ,因k正和k逆只与温度有关,反应进行到a点处时v正= k正x2(SiHCl3)=0.82k正,v逆= k逆x(SiH2Cl2)x(SiCl4)=0.12k逆。
,因k正和k逆只与温度有关,反应进行到a点处时v正= k正x2(SiHCl3)=0.82k正,v逆= k逆x(SiH2Cl2)x(SiCl4)=0.12k逆。![]() ×
×![]() =
=![]() ×
×![]() =
=![]() ,C正确;
,C正确;
D.恒容条件下再充入1mol SiHCl3,相当于增大压强,而2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)反应前后气体体积不变,所以平衡不移动,x(SiH2Cl2)不变,D错误;
SiH2Cl2(g)+SiCl4(g)反应前后气体体积不变,所以平衡不移动,x(SiH2Cl2)不变,D错误;
答案为C。