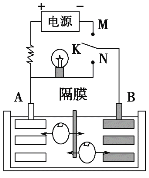
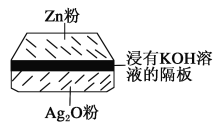
题目内容
【题目】(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”)。
(2)基态Fe2+的电子排布式为___。
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | … |
I0/kJ·mol-1 | 578 | 1817 | 2745 | 11575 | … |
则该元素的元素符号是___。
(4)NO3-的空间构型__(用文字描述),SO42-中硫原子的杂化方式为___。
(5)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___、中心原子的杂化形式为___。根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是___。
(6)与O3分子互为等电子体的一种阴离子为___(填化学式)。
(7)N2分子中σ键与π键的数目比n(σ):n(π)=___。
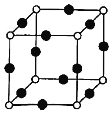
(8)Cu、N两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是___(用元素符号表示);若晶胞的棱长a nm,阿伏加德罗常数为NA,则该晶体的密度为___g/cm3(用含a、NA的式子表示)。
【答案】大于 1s22s22p63s23p63d6 Al 平面三角形 sp3杂化 正四面体 sp3 H2S NO2- 1:2 Cu3N ![]()
【解析】
(1)Zn的第一电离能应该高于Cu的第一电离能,原因是,Zn的核外电子排布已经达到了每个能级都是全满的稳定结构,所以失电子比较困难。同时也可以考虑到Zn最外层上是一对电子,而Cu的最外层是一个电子,Zn电离最外层一个电子还要拆开电子对,额外吸收能量;
故答案为大于;
(2)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,Fe2+在基态时,核外电子排布式为:1s22s22p63s23p63d6;
(3)从表中原子的第一至第四电离能可以看出,元素的第一、第二、第三电离能都较小,可失去3个电子,最高化合价为+3价,即最外层应有3个电子,应为Al元素;
(4)根据NO3-的中心原子的价层电子对数为![]() =3, 所以氮原子杂化方式为sp2杂化,离子中没有孤电子对,所以其空间构型为平面三角形,SO42-中硫原子的价层电子对数为
=3, 所以氮原子杂化方式为sp2杂化,离子中没有孤电子对,所以其空间构型为平面三角形,SO42-中硫原子的价层电子对数为![]() =4,所以硫原子的杂化方式为sp3杂化;
=4,所以硫原子的杂化方式为sp3杂化;
(5) LiAlH4中的阴离子是AlH4-,中心原子铝原子含有的价层电子对数是4,且不存在孤对电子,所以空间构型是正四面体,中心原子的杂化轨道类型是sp3杂化;
根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数分别是2+![]() =4、2+
=4、2+![]() =3、3+
=3、3+![]() =3,因此不同于其他分子的是H2S;
=3,因此不同于其他分子的是H2S;
(6)用替代法,与O3互为等电子体的一种阴离子为NO2-;
(7)N2的结构式为N![]() N,三键中含1个σ键和2个π键,N2分子中σ键与π键的数目比n(σ):n(π)=1:2;
N,三键中含1个σ键和2个π键,N2分子中σ键与π键的数目比n(σ):n(π)=1:2;
(8)该晶胞中N原子个数=8×![]() =1,Cu原子个数=12×
=1,Cu原子个数=12×![]() =3,所以其化学式为Cu3N;
=3,所以其化学式为Cu3N;
若晶胞的棱长a nm,其体积为a3 nm3,阿伏加德罗常数为NA,则该晶体的密度为![]() =
=![]() g/cm3。
g/cm3。

【题目】如图是元素周期表的一部分,按要求回答问题:
① |
| ||||||||||||||||
|
|
| ② | ③ | ④ |
|
| ||||||||||
⑤ | ⑥ |
|
|
|
|
|
|
|
|
|
| ⑦ |
|
| ⑧ | ⑨ |
|
(1)请写出下列元素的元素符号:①________③_________⑨___________。
(2)元素①④按2:1组成的化合物中化学键为_________。(填“共价键”或“离子键”)
(3)②的单质与⑧的最高价氧化物水化物热的浓溶液反应的化学方程式为____________。
(4)⑤⑥⑦的最高价氧化物水化物的碱性从大到小的顺序____________。(填化学式)
(5)④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为____________(填离子符号)。
(6)④和⑧的氢化物稳定性从大到小的顺序为______________________。(填化学式)
(7)元素④的氢化物与⑤发生反应的方程式_____________,所得溶液PH____7(填“>”或“<”或“=”)。
【题目】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醇(在水中溶解度不大、易溶于有机溶剂,密度约等于水的密度)和苯甲酸。反应原理如下:2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa、C6H5COONa+HC1→C6H5COOH+NaC1
有关物质物理性质如表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | -15 | 12 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21g | 0.34g | 5.9g |
实验流程如图:

(1)第①步需连续加热1小时(如图1),其中加热和固定装置未画出。仪器A的名称为____,若将仪器B改为仪器C,效果不如B,说明原因____。

(2)操作②的实验名称为____。
(3)操作③用沸水浴加热蒸馏,再进行操作④(如图2),收集___℃的馏分。图2中有一处明显错误,正确的应改为____。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用___冲洗杯壁上残留的晶体,抽滤完成后用____洗涤晶体。
(5)用电子天平准确称取0.2440g苯甲酸样品于锥形瓶中,加100mL蒸馏水溶解(必要时可以加热),再用0.1000 mol·L-1的标准NaOH溶液滴定,共消耗NaOH溶液19.20mL,滴定选用的指示剂为___,苯甲酸样品的纯度为____%(保留4位有效数字)。
【题目】下列实验中,实验现象及结论都正确且两者具有因果关系的是
实验 | 现象 | 结论 | |
A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. A B. B C. C D. D