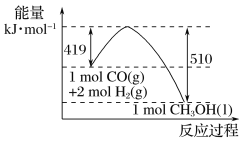
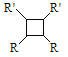
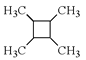
题目内容
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
【答案】D
【解析】
A.根据图像可知,0.1mol/LMOH溶液的pH=13,说明MOH完全电离,为强电解质,而ROH溶液的pH<13,说明ROH为弱电解质,所以MOH的碱性强于ROH的碱性,故A正确;
B.ROH为弱碱,溶液越稀越易电离,所以ROH的电离程度:b点大于a点,故B正确;
C.两溶液无限稀释下去,最终的pH均为7,所以它们的氢氧根离子浓度相等,故C正确;
D.当lgV/V0=2时,MOH溶液的pH=11,ROH溶液的pH=10,MOH溶液中不存在电离平衡,升高温度,对c(M+)无影响;而ROH溶液中存在电离平衡,升高温度,电离正向移动,则c(R+)浓度增大。综上所述,升高温度时,c(M+)/c(R+)比值减小,故D错误。
故选D。

【题目】下表为元素周期表的一部分,请参照元素①—⑨在表中的位置,回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中⑧元素单质可用作________。
(2)③、④、⑧的原子半径最小是________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物中,碱性最强的是________(用化学式回答)。
(4)②、③、④的气态氢化物中,稳定性最弱的是________(用化学式回答)(5)②和③按原子数![]() 形成的化合物的电子式为________,该晶体气化的过程中克服的微粒间作用力为________。
形成的化合物的电子式为________,该晶体气化的过程中克服的微粒间作用力为________。
(6)③和⑧形成的化合物属于________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:________________。
【题目】(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”)。
(2)基态Fe2+的电子排布式为___。
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | … |
I0/kJ·mol-1 | 578 | 1817 | 2745 | 11575 | … |
则该元素的元素符号是___。
(4)NO3-的空间构型__(用文字描述),SO42-中硫原子的杂化方式为___。
(5)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___、中心原子的杂化形式为___。根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是___。
(6)与O3分子互为等电子体的一种阴离子为___(填化学式)。
(7)N2分子中σ键与π键的数目比n(σ):n(π)=___。
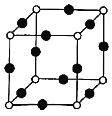
(8)Cu、N两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是___(用元素符号表示);若晶胞的棱长a nm,阿伏加德罗常数为NA,则该晶体的密度为___g/cm3(用含a、NA的式子表示)。