题目内容
【题目】如图是元素周期表的一部分,按要求回答问题:
① |
| ||||||||||||||||
|
|
| ② | ③ | ④ |
|
| ||||||||||
⑤ | ⑥ |
|
|
|
|
|
|
|
|
|
| ⑦ |
|
| ⑧ | ⑨ |
|
(1)请写出下列元素的元素符号:①________③_________⑨___________。
(2)元素①④按2:1组成的化合物中化学键为_________。(填“共价键”或“离子键”)
(3)②的单质与⑧的最高价氧化物水化物热的浓溶液反应的化学方程式为____________。
(4)⑤⑥⑦的最高价氧化物水化物的碱性从大到小的顺序____________。(填化学式)
(5)④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为____________(填离子符号)。
(6)④和⑧的氢化物稳定性从大到小的顺序为______________________。(填化学式)
(7)元素④的氢化物与⑤发生反应的方程式_____________,所得溶液PH____7(填“>”或“<”或“=”)。
【答案】H N Cl 共价键 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O NaOH>Mg(OH)2>Al(OH)3 Mg2+<Na+<O2-<S2- H2O>H2S 2Na+2H2O=2NaOH+H2↑ >
CO2↑+2SO2↑+2H2O NaOH>Mg(OH)2>Al(OH)3 Mg2+<Na+<O2-<S2- H2O>H2S 2Na+2H2O=2NaOH+H2↑ >
【解析】
根据各元素在周期表中的位置,各元素为:①H②C③N④O⑤Na⑥Mg⑦Al⑧S⑨Cl。
(1)根据各元素在周期表中的位置,元素的元素符号:①H③N⑨Cl。故答案为:H;N;Cl;
(2)元素①④按2:1组成的化合物为H2O,H与O之间通过共用电子对形成的化学键为共价键。故答案为:共价键;
(3)碳和浓硫酸反应生成二氧化碳、二氧化硫和水,反应的化学方程式C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(4)同周期从左到右元素的金属性减弱,最高价氧化物水化物的碱性减弱,金属性:Na>Mg>Al,最高价氧化物水化物的碱性从大到小的顺序NaOH>Mg(OH)2>Al(OH)3。故答案为:NaOH>Mg(OH)2>Al(OH)3;
(5)电子层结构相同的离子,核电荷越大,半径越小,④⑤⑥形成的简单离子,Mg2+<Na+<O2-,S2-比O2-多一个电子层,S2-半径大,④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为Mg2+<Na+<O2-<S2-。故答案为:Mg2+<Na+<O2-<S2-;
(6)④和⑧属于同一主族,从上到下氢化物稳定性减弱,氢化物稳定性从大到小的顺序为H2O>H2S。故答案为:H2O>H2S;
(7)水与钠发生反应生成氢氧化钠和氢气,方程式2Na+2H2O=2NaOH+H2↑,所得NaOH溶液呈强碱性,pH>7。故答案为:2Na+2H2O=2NaOH+H2↑,>。

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表的一部分,请参照元素①—⑨在表中的位置,回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中⑧元素单质可用作________。
(2)③、④、⑧的原子半径最小是________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物中,碱性最强的是________(用化学式回答)。
(4)②、③、④的气态氢化物中,稳定性最弱的是________(用化学式回答)(5)②和③按原子数![]() 形成的化合物的电子式为________,该晶体气化的过程中克服的微粒间作用力为________。
形成的化合物的电子式为________,该晶体气化的过程中克服的微粒间作用力为________。
(6)③和⑧形成的化合物属于________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:________________。
【题目】(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”)。
(2)基态Fe2+的电子排布式为___。
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | … |
I0/kJ·mol-1 | 578 | 1817 | 2745 | 11575 | … |
则该元素的元素符号是___。
(4)NO3-的空间构型__(用文字描述),SO42-中硫原子的杂化方式为___。
(5)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___、中心原子的杂化形式为___。根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是___。
(6)与O3分子互为等电子体的一种阴离子为___(填化学式)。
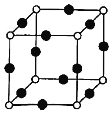
(7)N2分子中σ键与π键的数目比n(σ):n(π)=___。
(8)Cu、N两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是___(用元素符号表示);若晶胞的棱长a nm,阿伏加德罗常数为NA,则该晶体的密度为___g/cm3(用含a、NA的式子表示)。