题目内容
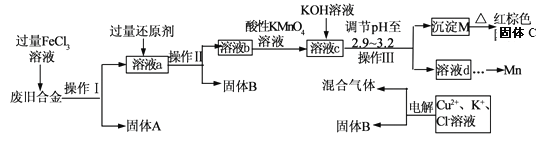
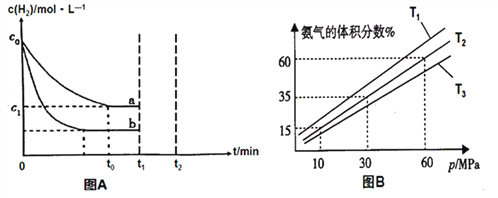
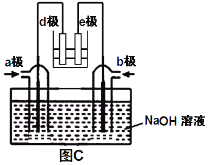
【题目】己知A、B、C、D、E五种元素是元素周期表中前四周期元素,且原子序数依次增大,其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子。 D、E 为同周期元素且分别位于s区和d区。五种元素所有的s能级电子均为全充满。E的d能级电子数比A、B、C最高能层的P能级电子数之和少一个。回答下列问题:
(1)五种元素中,电负性最大的是___________________(填元素符号)。
(2)E常有+2、+3两种价态,写出E2+的最外层电子排布式________________________。
(3)自然界中,含A的钠盐是一种天然矿藏,其化学式写作Na2A4O7·10H2O,实际上它的结构单元是由两个H3AO3和两个[A(OH)4]-缩合而成的双六元环,应该写成Na2A4O5(OH)4·8H2O,其结构如图1。①A原子的杂化轨道类型为_______________________________。
②该阴离子由极性键和配位键构成,请在图1中用“→”标出其中的配位键____________。
③已知H3AO3为一元弱酸,根据上述信息,用离子方程式解释分析H3AO3为一元酸的原因(用元素符号表示)____________________________________。
(4)①写出ECl3与苯酚(C6H5OH)反应生成[E(OC6H5)6]3-的化学方程式:________________________。
②请从分子结构的角度解释苯酚室温下在水中的溶解度小,当温度高于65℃时,能与水混溶:_______________________________________________________。
(5)由元素B、D组成的某离子化合物的晶胞结构如图2,写出该物质的电子式_____________________,若晶胞的长、宽、高分别为520pm、520pm和690pm,该晶体密度为______________g/cm3(保留到小数点后两位)。

【答案】 O 3d64s2 sp2 、sp3  H3BO3+H2O
H3BO3+H2O![]() [B(OH)4]-+H+ FeCl3+6C6H5OH→H3[Fe(OC6H5)6]+3HCl 因为苯酚分子间形成氢键,不与水形成氢键,所以室温溶解度小,但当温度超过65℃时,苯酚与苯酚之间的氢键被破坏,与水形成氢键,所以能溶
[B(OH)4]-+H+ FeCl3+6C6H5OH→H3[Fe(OC6H5)6]+3HCl 因为苯酚分子间形成氢键,不与水形成氢键,所以室温溶解度小,但当温度超过65℃时,苯酚与苯酚之间的氢键被破坏,与水形成氢键,所以能溶 ![]() 2.28
2.28
【解析】己知A、B、C、D、E五种元素是元素周期表中前四周期元素,且原子序数依次增大,其中A、B、C为同周期的非金属元素,三元素处于短周期,且B、C原子中均有两个未成对电子。二者外围电子排布式分别为ns22p2,ns22p4,结合A为非金属,A为硼元素,B为碳元素,C为氧元素,D、E 为同周期元素且分别位于s区和d区。五种元素所有的s能级电子均为全充满。则D为Ca元素,E的d能级电子数比A、B、C最高能层的P能级电子数之和少一个,为(1+2+4-1)=6,E为Fe。
(1)同周期的元素,从左到右电负性依次增大,同主族的元素,从上到下,电负性依次减少,非金属越强,电负性越大,五种元素中,电负性最大的是O元素。(2)E常有+2、+3两种价态,写出E2+的最外层电子排布式 3d6 4s2 ;(3)①图1中A原子为B原子,分别形成3个或4个σ键,杂化轨道类型为SP2和SP3;②该阴离子由极性键和配位键构成,形成4个σ键的有一个是配位键,如图所示, ;③用离子方程式解释分析H3AO3为一元酸的原因:H3BO3上有一个空轨道,水中氧上有孤电子对,形成配位键,H3BO3+H2O
;③用离子方程式解释分析H3AO3为一元酸的原因:H3BO3上有一个空轨道,水中氧上有孤电子对,形成配位键,H3BO3+H2O![]() [B(OH)4]-+H+ ;(4)①FeCl3与苯酚(C6H5OH)反应生成[Fe(OC6H5)6]3-的化学方程式:FeCl3+6C6H5OH→H3[Fe(OC6H5)6]+3HCl ;②从分子结构的角度解释苯酚室温下在水中的溶解度小,当温度高于65℃时,能与水混溶:因为苯酚分子间形成氢键,不与水形成氢键,所以室温溶解度小,但当温度超过65℃时,苯酚与苯酚之间的氢键被破坏,与水形成氢键,所以能溶。(5)由元素C、Ca组成的某离子化合物CaC2,晶胞结构如图2,写出该物质的电子式
[B(OH)4]-+H+ ;(4)①FeCl3与苯酚(C6H5OH)反应生成[Fe(OC6H5)6]3-的化学方程式:FeCl3+6C6H5OH→H3[Fe(OC6H5)6]+3HCl ;②从分子结构的角度解释苯酚室温下在水中的溶解度小,当温度高于65℃时,能与水混溶:因为苯酚分子间形成氢键,不与水形成氢键,所以室温溶解度小,但当温度超过65℃时,苯酚与苯酚之间的氢键被破坏,与水形成氢键,所以能溶。(5)由元素C、Ca组成的某离子化合物CaC2,晶胞结构如图2,写出该物质的电子式![]() ;晶胞中Ca2+ 和C22―个数相同,
;晶胞中Ca2+ 和C22―个数相同,![]() ,晶胞质量为:
,晶胞质量为:![]() ,若晶胞的长、宽、高分别为520pm、520pm和690pm,该晶体密度为
,若晶胞的长、宽、高分别为520pm、520pm和690pm,该晶体密度为
![]() 。
。