题目内容
【题目】氨气有广泛用途,工业上利用反应N2(g)+3H2(g)![]() 2NH3(g) H<0合成氨,回答以下问题:
2NH3(g) H<0合成氨,回答以下问题:
(1)某小组为了探究外界条件对反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
①a条件下,0~t0的平均反应速率v(H2)=_____________mol·L-1·min-1。
②相对a而言,b可能改变的条件是________________。
③在a条件下t1时刻将容器体积压缩至原来的1/2,t2时刻重新建立平衡状态。请在答题卡相应位置画出t1时刻后c(H2)的变化曲线并作相应的标注。_____________
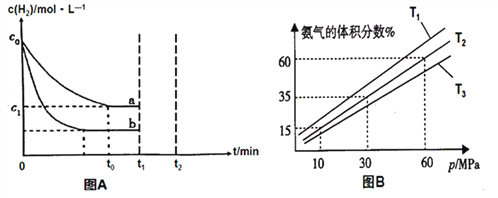
(2)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图B为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。
① 比较T1、T3的大小T1__________T3(填“<”或“>”)。
②分析体系在T2、60MPa下达到的平衡,此时N2的平衡分压为_______MPa(分压=总压×物质的量分数);列式表示此时的平衡常数Kp=______________。(用平衡分压代替平衡浓度,不要求计算结果)
(3)有人利用NO2和NH3构成电池的方法,既能实现有效消除氮氧化物的排放减少环境污染,又能充分利用化学能进行粗铜精炼,如图C所示,d极为粗铜。
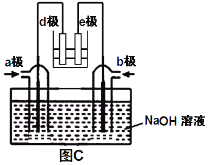
① a极通入________(填化学式);
② b极电极反应为_____________________________。
【答案】 (c0-c1)/t0 增大c(N2)  < 9
< 9 ![]() NO2 2NH3—6e—+6OH—=N2+6H2O
NO2 2NH3—6e—+6OH—=N2+6H2O
【解析】(1)①根据图像可知,0~t0的平均反应速率v(H2)=(c0-c1)/t0 mol·L-1·min-1;正确答案:(c0-c1)/t0。
②从图像可出:达到平衡时,氢气的平衡浓度变小,时间缩短,速率加快;增大压强,平衡右移,但是氢气浓度增大,与题意矛盾;增加氮气的浓度,平衡右移,氢气的转化率增大,速率加快,符合题意;正确答案:增大c(N2)。
③体积缩小1/2,氢气的浓度会从c1突增到2 c1,然后根据缩小体积、增大压强,平衡右移,氢气的浓度减少但始终在c1与2 c1之间;正确答案: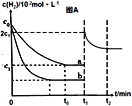 。
。
(2)①该反应为放热反应,当压强不变的情况下,降低温度,平衡右移,氨气的体积分数增大,从图像看出,T1小于T3;正确答案:<。
②设氮气的变化量为xmol,根据反应
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始量 9 23 0
变化量 x 3 x 2 x
平衡量 9- x 23-3x 2 x
氨气的体积分数= 2x÷(9- x+ 23-3x+2x)=60%,解之x=6mol;把x=6带入下式可得:N2的物质的量分数=(9- x)÷(9- x+ 23-3x+2x)=3/20,此时N2的平衡分压为60×3/20=9;H2的物质的量分数=(23-3x)÷(9- x+ 23-3x+2x)=1/4, 此时H2的平衡分压为60×1/4=15;NH3的物质的量分数60%,此时NH3的平衡分压为60×60%=36;此时的平衡常数Kp=![]() ;正确答案:9;
;正确答案:9;![]() 。
。
(3)粗铜精炼中,粗铜做电解池的阳极,因此与d 极相连的a极为原电池的正极,发生还原反应,NO2和NH3反应生成氮气和水,NO2中+4价氮元素降低到0价,被还原;因此a极通入NO2;b极为原电池的负极,氨气在此极发生氧化反应生成氮气,极反应为2NH3—6e—+6OH—=N2+6H2O;正确答案:NO2;2NH3—6e—+6OH—=N2+6H2O。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。
【题目】已知几种难溶电解质的溶度积如下表所示:
几种难溶电解质的Ksp(25℃) | |
沉淀溶解平衡 | Ksp |
AgBr(s) | 5,0×10-13 mol2·L-2 |
AgI(s) | 8.3×10-17 mol2·L-2 |
FeS(s) | 6.3×10-18 mol2·L-2 |
ZnS(s) | 1.6×10-24 mol2·L-2 |
CuS(s) | 1.3×10-36 mol2·L-2 |
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺为:____________________。
(2)向饱和的AgI溶液中加入固体硝酸银,则c( I- )________(填“增大”、“减小”或“不变”),若改加AgBr固体,则c(Ag+)__________(填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是_____________________(用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡: ZnS(s)![]() Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 _______。
Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 _______。
A.加入少量CuS固体 B.加入少量FeS固体
C.加入少量FeCl2固体 D.加入少量CuCl2固体
