题目内容
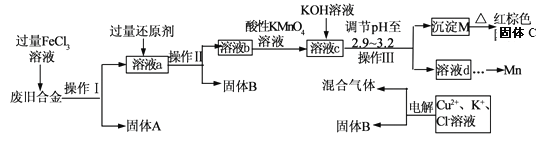
【题目】某化学兴趣小组对一种废旧合金(含有Cu、Fe、Si等元素)进行分离、回收再利用,所设计工艺流程如下。
已知:298K时,Ksp[Fe(OH)3]=4.0×10—38,Ksp[Cu(OH)2]=2.2×10一20,
Ksp[Mn(OH)2]=1.9×10—13
回答下列问题:
(1)操作I、Ⅱ、Ⅲ为________,固体B为_________ (填化学式)。
(2)加人过量FeCl3溶液过程中与较不活泼的金属反应的离子方程式__________________。
(3)调节pH至2.9~3.2的目的是分离_________ (填离子符号)
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为_________________。
②若用 a mol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液V mL,所得红棕色固体C的物质的量为_________(用含a、v的代数式表示)
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后生成的沉淀为_________ (填化学式)。
(6)用惰性电极电解时阳极产生标准状况下的气体6.72L,阴极得到的电子数为0.8NA,则生成氧气的物质的量为________ mol.
【答案】 过滤 Cu 2Fe3+ +Cu= 2Fe2++Cu2+ Fe3+ MnO4- + 5Fe2+ + 8H+= Mn2++ 5Fe3++4H2O 2.5aV×10-3mol Mn(OH)2 0.1
【解析】试题分析:由流程可知,合金经氯化铁溶液溶解后把其中的铁和铜溶解,过滤后除去硅;向滤液中加入过量的铜,把过量的Fe3+还原,过滤得到铜,再向滤液中加入酸性高锰酸钾溶液把亚铁离子完全氧化为+3价铁离子,然后再加碱调节pH使+3价铁离子转化为氢氧化铁沉淀;滤液经处理后电解,阳极得到氯气和氧气、阴极得到铜。
(1)操作I、Ⅱ、Ⅲ为过滤,固体B为Cu。
(2) FeCl3溶液与较不活泼的金属铜反应的离子方程式为2Fe3+ +Cu= 2Fe2++Cu2+。
(3)调节pH至2.9~3.2的目的是分离Fe3+。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为MnO4- + 5Fe2+ + 8H+= Mn2++ 5Fe3++4H2O。
②若用 a mol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液V mL,由反应的离子方程式可知,n(Fe3+)=5n(KMnO4)=5![]() V
V ![]() =5aV
=5aV ![]() ,所得红棕色固体C为Fe2O3,其物质的量为2.5aV×10-3mol 。
,所得红棕色固体C为Fe2O3,其物质的量为2.5aV×10-3mol 。
(5)常温下,溶液c中所含的金属阳离子为Fe3+、Cu2+和Mn2+,若三者浓度相等,向溶液c中逐滴加入KOH溶液,因为Ksp[Fe(OH)3] ![]() Ksp[Cu(OH)2]
Ksp[Cu(OH)2] ![]() Ksp[Mn(OH)2],所以先生成的沉淀是Fe(OH)3(由流程可知,pH=3.2时,Fe3+沉淀完全,而Cu2+和Mn2+尚未开始沉淀),最后生成的沉淀为Mn(OH)2。
Ksp[Mn(OH)2],所以先生成的沉淀是Fe(OH)3(由流程可知,pH=3.2时,Fe3+沉淀完全,而Cu2+和Mn2+尚未开始沉淀),最后生成的沉淀为Mn(OH)2。
(6)用惰性电极电解时阳极产生标准状况下的气体6.72L,阴极得到的电子数为0.8NA,由电子转移守恒得,4n(O2)+2[![]() ]=0.8mol,则生成氧气的物质的量为0.1mol.
]=0.8mol,则生成氧气的物质的量为0.1mol.

【题目】已知25℃、101kPa时,一些物质的燃烧热为,回答下列问题:
化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
△H/(kJ·mol-l) | -283.0 | -285.8 | -726.5 | -890.3 |
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:_____________________________。
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)![]() CH3OH(l)△H=__________。
CH3OH(l)△H=__________。
(3)工业上利用水煤气合成甲醇的主要反应可表示为![]() CO(g)+H2(g)
CO(g)+H2(g)![]()
![]() CH3OH(g)△H=-45.4kJ·mol-1。向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
CH3OH(g)△H=-45.4kJ·mol-1。向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
①相同温度条件下,上述反应的化学平衡常数K=___________。
②若容器容积不变,下列措施可增加CH3OH产率的是___________ (填标号)。
a.升高温度
b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大
d.再充入0.10molH2和0.05molCO
e.加入催化剂
③反应达到平衡后,保持其他条件不变,若只把容器的体积缩小一半,平衡将___________(填“逆向”“正向”或“不”)移动,化学平衡常数K___________(填“增大”“减小”或“不变”)。
④温度、容积相同的甲、乙两个密闭容器,若甲中加入1molCO和2molH2,乙中加入lmolCH3OH(g),反应达到平衡时甲放出的热量为Q1kJ,乙吸收的热量为Q2kJ,甲中CO的转化率为a1,乙中CH3OH的转化率为a2,则Q1+Q2=___________,a1+a2=___________。
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。
【题目】(1)为了检验和除去下表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内。
物质 | 检验试剂 | 除杂试剂 |
(Ⅰ)甲烷(乙烯 ) | __________ | __________ |
(Ⅱ)酒精(水) | __________ | __________ |
①检验试剂:A.无水硫酸铜 B.酸性高锰酸钾溶液 C.水 D.氢氧化钠溶液
②除杂试剂:a.无水硫酸铜 b.乙酸c.新制的生石灰 d.溴水
除杂时,乙烯发生反应的化学方程式为______________________________________。
(2)如图,在左侧试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。按图连接好装置,用酒精灯对左侧试管小火加热3~5 min后,改用大火加热,当观察到右侧试管中有明显现象时停止实验。

试回答:在右侧试管中通常加入________溶液,实验生成的乙酸乙酯的密度比水________,是有特殊香味的液体。分离右侧试管中所得乙酸乙酯的操作为________(只填名称)。反应中浓硫酸的作用是__________。




