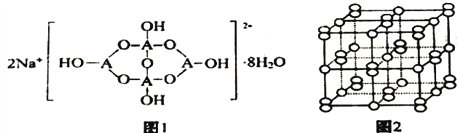
题目内容
【题目】氯碱工业中,通过电解饱和食盐水获得重要的化工原料。其中氯气用途十分广泛,除用于自来水消毒、生产漂白粉外,还用于生产盐酸、聚氯乙烯、氯苯等。
(1)写出电解饱和食盐水的化学方程式:______________________________。
(2)氯气用于生产半导体材料硅的流程如下:
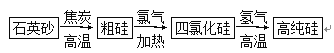
①石英砂的主要成分是________,在制备粗硅时,焦炭的作用是________。
②写出四氯化硅得到高纯硅的化学方程式:______________________。
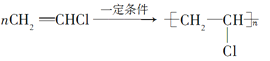
(3)用于制造塑料薄膜、人造革、塑料管材和板材的聚氯乙烯(PVC塑料)就是以氯气和乙烯为主要原料通过三步主要反应生产的。三步反应的化学方程式分别为
①___________________________________________________________;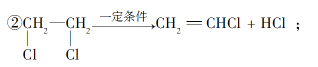
③___________________________________________________________。
其中①、③的反应类型分别为________反应、________反应。
(4)上述两种生产过程可得到同一种副产品,该副产品是________。
【答案】2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑SiO2作还原剂SiCl4+2H2
2NaOH+H2↑+Cl2↑SiO2作还原剂SiCl4+2H2![]() Si+4HCl
Si+4HCl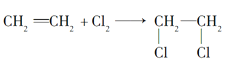
 加成加聚HCl
加成加聚HCl
【解析】
(1) 电解饱和食盐水生成氢氧化钠、氯气和氢气,反应的化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;(2) ①石英砂的主要成分是SiO2,,C元素的化合价升高,则焦炭作还原剂;②用Cl2制备纯硅涉及反应:2Cl2+Si(粗)
2NaOH+H2↑+Cl2↑;(2) ①石英砂的主要成分是SiO2,,C元素的化合价升高,则焦炭作还原剂;②用Cl2制备纯硅涉及反应:2Cl2+Si(粗)![]() SiCl4,体现了氯气的强氧化性,再由SiCl4制取高纯硅,用H2使之还原,用SiCl4得到高纯硅的化学方程式为SiCl4+2H2
SiCl4,体现了氯气的强氧化性,再由SiCl4制取高纯硅,用H2使之还原,用SiCl4得到高纯硅的化学方程式为SiCl4+2H2![]() Si+4HCl;(3)用Cl2与乙烯为原料制聚氯乙烯,发生反应:
Si+4HCl;(3)用Cl2与乙烯为原料制聚氯乙烯,发生反应: ![]()
![]() ,
, 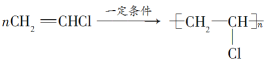 ,①、③的反应类型分别为加成反应、加聚反应;(4)在两种材料制备反应中均可得副产品HCl。
,①、③的反应类型分别为加成反应、加聚反应;(4)在两种材料制备反应中均可得副产品HCl。

【题目】下表是元素周期表中的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | E | F | H | J | ||||
3 | B | C | D | G | I |
根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是________,氧化性最强的单质是________,还原性最强的单质是________。
(2)最高价氧化物对应的水化物中,碱性最强的是________,酸性最强的是________,呈两性的是________。
(3)A分别与E、F、G、H、I形成的简单气态化合物中,最稳定的是________。
(4)在B、C、D、G、I中,原子半径最大的是________。
(5)元素C与I形成的化合物的电子式是________。