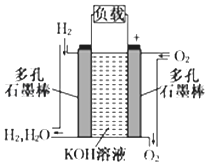
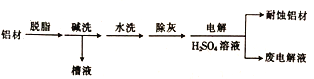
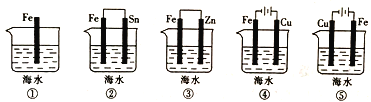
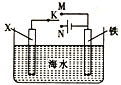
题目内容
【题目】某课外活动小组为了测定某(CuCl22H2O)样品的纯度,设计了如下方案:称取1.0 g样品溶解于适量水中,向其中加入含AgNO3 2.38 g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2 mol·L-1的KSCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定样品的纯度。请回答下列问题:
(1)判断滴定达到终点的现象是___________________。
(2)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果_____________(选填“偏高”、“偏低”或“无影响”)。
(3)若到达滴定终点时,用去KSCN标准溶液20.00mL,求此样品的纯度__________。
【答案】 由黄色变为血红色,且半分钟内不变色(或者只说出现血红色,半分钟内不变色也可以) 偏高 85.5%
【解析】(1)反应过程中用含Fe3+的溶液作指示剂,用KSCN标准溶液滴定剩余的AgNO3,滴入最后一滴后,溶液由黄色变为血红色,且半分钟内不变色,证明反应达到终点,故答案为:溶液由黄色变为血红色,且半分钟内不变色;
(2)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,因为硝酸银的总量一定,若两种沉淀表面吸附部分Ag+,导致测得过量的Ag+偏少,则与Cl-反应的Ag+的量会偏高,即n(Cl-)的测定结果偏高,故答案为:偏高;
(3)根据关系式KSCN~AgNO3可知,过量的AgNO3的质量为0.2 mol/L×0.02 L×170g/mol=0.68g,则根据:CuCl22H2O~2AgNO3,可知样品中CuCl22H2O的质量为: ![]() =0.855g,则原CuCl22H2O晶体的纯度为
=0.855g,则原CuCl22H2O晶体的纯度为![]() ×100%=85.5%,故答案为:85.5%。
×100%=85.5%,故答案为:85.5%。

 阅读快车系列答案
阅读快车系列答案【题目】(1)常温下,用0.1000mol/LCH3COOH溶液滴定NaOH溶液,达到滴定终点时,溶液中各离子浓度从大到小的顺序为________;为了减小滴定误差在滴定实验中使用的酸碱指示剂最好是________(填序号)
A、石蕊 B、甲基橙 C、酚酞 D、甲基橙或酚酞
(2)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为C1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为C2,则C1/C2=________。
(3)已知H2A的电离方程式为:H2A=H++HA-;HA-![]() H++A2-。试判断H2A是_________(填“强”“弱”)电解质。
H++A2-。试判断H2A是_________(填“强”“弱”)电解质。
(4)已知CH3COOH在溶剂A中可以全部电离,盐不溶解于A溶剂。则CH3COOH和Na2CO3在溶剂A中生成CO2反应的离子方程式是________。
(5)电离平衡常数是衡量弱电解质电离程度的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等浓度的HCN溶液、H2CO3溶液和CH3COOH溶液,三溶液的pH由大到小的顺序为__________________(用化学式表示)。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为__________________。