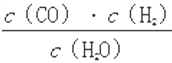题目内容
【题目】对金属制品进行抗腐蚀处理,可减缓金属的腐蚀,延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
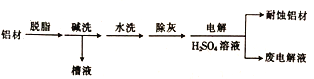
①碱洗的目的是除去铝表面的自然氧化膜(Al2O3),有关反应的离子方程式为_________________。碱洗时常有气泡冒出,该气体是_________ (填化学式)。
②电解时,处理好的铝材应与电源的________极相连,铝材表面形成氧化膜的电极反应式为_______。
(2)钢铁容易生锈的主要原因是钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在酸性环境下,其正极反应式为_________;在酸性很弱或中性条件下,其发生_______(填“析氢腐蚀”或“吸氧腐蚀”)。
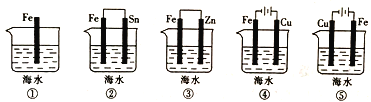
(3)下列装置中铁片腐蚀由快到慢的顺序是____________(用序号表示)。
(4)利用如图装置,可以模拟铁的电化学防护。
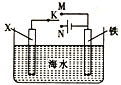
若X为碳棒,开关K置于N处,该电化学防护法称为______;若X为锌棒,开关K置于M处,_____(填“能”或“不能”)达到防止铁腐蚀的目的。
【答案】 Al2O3+2OH-=2AlO2-+H2O H2 正 2Al+3H2O-6e-==Al2O3+6H+ 2H+ +2e-=H2↑ 吸氧腐蚀 ⑤>②>①>③>④ 外加电流的阴极保护法 能
【解析】(1)①Al2O3是两性氧化物,与OH-反应生成AlO2-和H2O,离子方程式为:Al2O3+2OH-=2AlO2-+H2O;因为Al具有两性,能与OH-反应生成AlO2-和H2,所以碱洗时常有气泡冒出,该气体是H2。②要通过电解使处理好的铝材表面形成氧化膜,处理好的铝材应与电源的正极相连发生氧化反应,又根据酸性电解质溶液,所以电极反应式为:2Al+3H2O-6e-=Al2O3+6H+。
(2)在酸性环境下,钢铁易发生析氢腐蚀,H+在正极上得到电子生成H2,所以正极反应式为:2H++2e-=H2↑;在酸性很弱或中性条件下,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应,称为吸氧腐蚀。
(3)由图可知,①为化学腐蚀,②③装置是原电池,在②中,金属铁做负极,③中金属铁作正极,做负极的腐蚀速率快,并且两个电极金属活泼性相差越大,负极金属腐蚀速率越快,正极被保护,并且原电池原理引起的腐蚀>化学腐蚀,所以②>①>③,④⑤装置是电解池,④中铁为阴极,⑤中铁为阳极,阳极金属被腐蚀的速率快,阴极被保护,即⑤>④,根据电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀,并且原电池的正极金属腐蚀速率快于电解池的阴极金属腐蚀速率,所以铁腐蚀快慢顺序为:⑤>②>①>③>④。
(4)X为碳棒,开关K置于N处,形成电解池,铁作阴极被保护,该电化学防护法称为外加电流的阴极保护法;若X为锌棒,开关K置于M处,形成原电池,Zn作负极、铁作正极,能达到防止铁腐蚀的目的。

 阅读快车系列答案
阅读快车系列答案【题目】下列除杂方案错误的是
选项 | 被提纯的物质 | 杂质 | 除杂试剂 |
A | FeCl3(aq) | Fe2+ | 新制氯水 |
B | FeCl2(aq) | Fe3+ | Cu粉 |
C | NaHCO3(aq) | Na2CO3 | CO2气体 |
D | Mg粉 | Al粉 | NaOH(aq)、过滤 |
A. A B. B C. C D. D