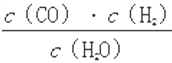题目内容
【题目】(1)常温下,用0.1000mol/LCH3COOH溶液滴定NaOH溶液,达到滴定终点时,溶液中各离子浓度从大到小的顺序为________;为了减小滴定误差在滴定实验中使用的酸碱指示剂最好是________(填序号)
A、石蕊 B、甲基橙 C、酚酞 D、甲基橙或酚酞
(2)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为C1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为C2,则C1/C2=________。
(3)已知H2A的电离方程式为:H2A=H++HA-;HA-![]() H++A2-。试判断H2A是_________(填“强”“弱”)电解质。
H++A2-。试判断H2A是_________(填“强”“弱”)电解质。
(4)已知CH3COOH在溶剂A中可以全部电离,盐不溶解于A溶剂。则CH3COOH和Na2CO3在溶剂A中生成CO2反应的离子方程式是________。
(5)电离平衡常数是衡量弱电解质电离程度的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等浓度的HCN溶液、H2CO3溶液和CH3COOH溶液,三溶液的pH由大到小的顺序为__________________(用化学式表示)。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为__________________。
【答案】 c(Na+)>c(CH3COO-)>c(OH-)>c(H+) C ![]() 强 Na2CO3+2H++2CH3COO-=2CH3COONa+H2O+CO2↑ H2CO3>HCN>CH3COOH NaCN+H2O+CO2=HCN+NaHCO3
强 Na2CO3+2H++2CH3COO-=2CH3COONa+H2O+CO2↑ H2CO3>HCN>CH3COOH NaCN+H2O+CO2=HCN+NaHCO3
【解析】(1)常温下,用0.1000mol/LCH3COOH溶液滴定NaOH溶液,当达到滴定终点时生成醋酸钠,醋酸根离子水解溶液显碱性,当达到滴定终点时溶液的pH>7,溶液中各离子浓度从大到小的顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),指示剂变色范围为:酚酞8-10,甲基橙为3.1-4.4,石蕊为5-8,为了减小滴定误差在滴定实验中使用的酸碱指示剂最好是酚酞,故选C,故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);C;
(2)硫酸溶液中的氢氧根离子、硫酸铝溶液中的氢离子是水电离的,pH=5的硫酸溶液中由水电离出的H+浓度为C1=![]() =10-9mol/L,pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为C2=10-5mol/L,则C1:C2=10-9mol/L:10-5mol/L=1:10000,故答案为:1:10000;
=10-9mol/L,pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为C2=10-5mol/L,则C1:C2=10-9mol/L:10-5mol/L=1:10000,故答案为:1:10000;
(3)已知H2A的电离方程式为:H2A=H++HA-;HA-H++A2-,H2A的第一步电离完全进行,所以H2A强电解质,故答案为:强;
(4)已知CH3COOH在溶剂A中可以全部电离,盐不溶解于A溶剂,所以碳酸钠和生成的醋酸钠不能写成离子,醋酸完全电离,据此书写离子方程式:Na2CO3+2H++2CH3COO- =2CH3COONa+H2O+CO2↑,故答案为:Na2CO3+2H++2CH3COO- =2CH3COONa+H2O+CO2↑;
(5)①根据酸的电离常数进行分析判断,电离常数越大,pH越小,根据表格数据分析,电离常数:醋酸>HCN>碳酸氢根离子,所以三溶液的pH由大到小的顺序为H2CO3>HCN>CH3COOH,故答案为:H2CO3>HCN>CH3COOH;
②向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>HCO3-,故反应生成HCN和碳酸氢钠,不能生成二氧化碳,故反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3,故答案为:NaCN+H2O+CO2=HCN+NaHCO3。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案【题目】下列除杂方案错误的是
选项 | 被提纯的物质 | 杂质 | 除杂试剂 |
A | FeCl3(aq) | Fe2+ | 新制氯水 |
B | FeCl2(aq) | Fe3+ | Cu粉 |
C | NaHCO3(aq) | Na2CO3 | CO2气体 |
D | Mg粉 | Al粉 | NaOH(aq)、过滤 |
A. A B. B C. C D. D