题目内容
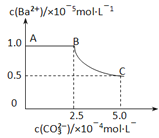
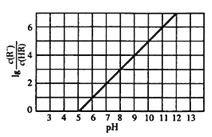
【题目】常温下,向lL0.lmol·L-1一元酸HR溶液中逐渐通人氨气[已知常温下Kb(NH3H2O)=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如右图所示。下列叙述正确的是
A. 0.1 mol·L-1HR溶液的pH约为3
B. HR为弱酸,常温时Ka (HR) =1×l0-7
C. 当通入0.1molNH3 时,c(R-) >c(NH4+)
D. 当c(HR) =c(R-)时,溶液必为中性
【答案】A
【解析】A.pH=5时,lg![]() =0,则
=0,则![]() = 1,说明HR在溶液中不能完全电离,HR是弱酸,根据HR
= 1,说明HR在溶液中不能完全电离,HR是弱酸,根据HR![]() H++R-可知,Ka(HR) =
H++R-可知,Ka(HR) = ![]() ,pH=5时,Ka(HR)=c(H+)=10-5mol/L,因溶液温度不变,则Ka始终不变。设0.1 mol·L-1HR溶液中H+的浓度为xmol/L,则Ka =
,pH=5时,Ka(HR)=c(H+)=10-5mol/L,因溶液温度不变,则Ka始终不变。设0.1 mol·L-1HR溶液中H+的浓度为xmol/L,则Ka = ![]() =
=![]() =10-5mol/L,解得x=10-3mol/L,则pH=-lgc(H+)=3,故A正确;B.根据A项分析可知,HR是弱酸,常温时Ka(HR)=10-5mol/L,故B错误;C. lL0.lmol·L-1一元酸HR溶液中n(HR)=0.1mol,当通入0.1molNH3 时,恰好与HR完全反应,得NH4R溶液,因Ka(HR)<Kb(NH3H2O),所以R-的水解程度大于NH4+的水解程度,则c(R-)<c(NH4+),故C错误;D.据图可知,当c(HR) =c(R-)时,lg
=10-5mol/L,解得x=10-3mol/L,则pH=-lgc(H+)=3,故A正确;B.根据A项分析可知,HR是弱酸,常温时Ka(HR)=10-5mol/L,故B错误;C. lL0.lmol·L-1一元酸HR溶液中n(HR)=0.1mol,当通入0.1molNH3 时,恰好与HR完全反应,得NH4R溶液,因Ka(HR)<Kb(NH3H2O),所以R-的水解程度大于NH4+的水解程度,则c(R-)<c(NH4+),故C错误;D.据图可知,当c(HR) =c(R-)时,lg![]() =0,pH=5,溶液成酸性,故D错误;答案选A。
=0,pH=5,溶液成酸性,故D错误;答案选A。

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目