题目内容
【题目】被誉为改变未来世界十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: 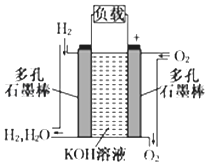
(1)通入氢气的一极为极.
(2)写出氢氧燃料电池工作时正极电极反应方程式: .
(3)该氢氧燃料电池每转移0.3mol电子,消耗标准状态下L氧气.
(4)若将此燃料电池改进为直接以甲醇(CH3OH)和氧气为原料进行工作时,负极反应式为 .
【答案】
(1)负极
(2)O2+2H2O+4e﹣=4OH﹣
(3)1.68
(4)CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O
【解析】解:(1)氢氧燃料电池中,通入燃料的电极是负极,即氢气进入的电极是负极,所以答案是:负极;(2)氢氧燃料电池中,电解质溶液为碱,则正极上氧气得电子和水生成氢氧根离子,则其电极反应式为:O2+2H2O+4e﹣=4OH﹣ , 所以答案是:O2+2H2O+4e﹣=4OH﹣;(3)根据电极反应O2+2H2O+4e﹣=4OH﹣可知转移4mol电子时,消耗氧气1mol,则每转移0.3mol电子消耗的氧气为: ![]() ×0.3mol=0.075mol,则V(O 2)=nVm=0.075mol×22.4L/mol=1.68L,所以答案是:1.68;(4)燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,甲醇在负极燃烧生成的二氧化碳再与氢氧根离子结合生成碳酸根离子,其电极反应式为:CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O,所以答案是:CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O.
×0.3mol=0.075mol,则V(O 2)=nVm=0.075mol×22.4L/mol=1.68L,所以答案是:1.68;(4)燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,甲醇在负极燃烧生成的二氧化碳再与氢氧根离子结合生成碳酸根离子,其电极反应式为:CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O,所以答案是:CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O.

【题目】下列除杂方案错误的是
选项 | 被提纯的物质 | 杂质 | 除杂试剂 |
A | FeCl3(aq) | Fe2+ | 新制氯水 |
B | FeCl2(aq) | Fe3+ | Cu粉 |
C | NaHCO3(aq) | Na2CO3 | CO2气体 |
D | Mg粉 | Al粉 | NaOH(aq)、过滤 |
A. A B. B C. C D. D