题目内容
17.下列说法正确的是( )| A. | pH=5的H2S溶液中,c(H+)=c(HS一)=1×10-5mol•L-1 | |
| B. | 含有AgCl和AgI固体的悬浊液中,c(Ag+)>c(Cl-)=c(I-) | |
| C. | 在新制氯水中加入氯化钠固体,水的电离平衡不移动 | |
| D. |  若R为Zn,则如图采用了牺牲阳极的阴极保护法 |
分析 A、H2S在水溶液中分两步电离:第一步:H2S?H++HS-,第二步:HS-?H++S2-,据此解答即可;
B、AgCl的溶解度大于AgI的溶解度;
C、新制氯水中存在平衡,Cl2+H2O?H++HClO+Cl-;
D、锌比铁活泼,在原电池中作负极,正极被保护.
解答 解:A、H2S在水溶液中分两步电离:第一步:H2S?H++HS-,第二步:HS-?H++S2-,故溶液中c(H+)=1×10-5mol•L-1>c(HS-),故A错误;
B、AgCl的溶解度大于AgI的溶解度,故在此饱和溶液中c(Ag+)>c(Cl-)>c(I-),故B错误;
C、新制氯水中存在平衡,Cl2+H2O?H++HClO+Cl-,加入氯化钠固体,即增加了氯离子浓度,故平衡左移氢离子浓度减小,导致水的平衡右移,故C错误;
D、锌比铁活泼,在原电池中作负极,正极(Fe)被保护,此为牺牲阳极阴极保护法,故D正确,故选D.
点评 本题主要考查的是弱酸的分步电离、离子浓度大小比较、平衡移动原理以及原电池工作原理,本题考查的较为全面,但难度不大.

练习册系列答案
相关题目
7.等质量的铁与过量的盐酸在不同的试验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到如图,则曲线a、b、c、d所对应的试验组别是( )
| 组别 | c(HCl)(mol•L-1) | 温度(℃) | 铁的状态 | 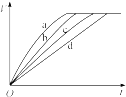 |
| 1 | 2.0 | 25 | 块状 | |
| 2 | 2.5 | 30 | 块状 | |
| 3 | 2.5 | 50 | 粉末状 | |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 3-4-2-1 | B. | 1-2-4-3 | C. | 4-3-2-1 | D. | 1-2-3-4 |
8.下列反应所得溶液中,一定只含一种溶质的是( )
| A. | 向氯化铝溶液中加入过量的氨水 | |
| B. | 向稀盐酸中滴入少量的NaAlO2溶液 | |
| C. | 向稀硝酸中加入铁粉 | |
| D. | 向硫酸酸化的MgSO4溶液中加入过量的Ba(OH)2溶液 |
5.对下列电解质溶液的叙述错误的是( )
| A. | 等物质的量浓度的Na2 C O3和NaHCO3混合液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| B. | 25℃时 0.2 mol•L-1盐酸与等体积0.05 mol•L-1Ba(OH)2溶液混合后,溶液的pH=l | |
| C. | pH=3的二元弱酸H2R溶液与pH=ll的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)十c(HR-)=c(Na+) | |
| D. | 25℃时,若0.3 mol•L-1 HY溶液与0.3 mol.L-lNaOH溶液等体积混合后,溶液的 pH=9,则:c(OH-)-c(HY)-c(H+)=1×lO-9 mol•L-1 |
12.已知X、Y、Z、R、W是原子序数依次增大的五种短周期主族元素,其中只有Z是金属元素,Y是地壳中含量最高的元素,X、Y、R在周期表中的相对位置关系如图.下列说法正确的是( )
| | X | | Y | |
| R |
| A. | 五种元素中原子半径最大的是W,离子半径最大的是R离子 | |
| B. | X、R、W三种元素的最高价氧化物所对应的水化物的酸性强弱关系为R>W>X | |
| C. | Y与Z形成的化合物一定是碱性氧化物 | |
| D. | Z与W形成的化合物水溶液可能显酸性 |
9.短周期元素X、Y、Z、W的原子序数依次增大,X-与Y2+电子层结构与Ne原子的电子层结构相同,Z单质是金属,W的最外层电子数是内层电子总数的一半,下列正确的是( )
| A. | 原子半径r(X)<r(Y),离子半径r(X-)>r(Y2+) | |
| B. | X的简单气态氢化物的稳定性比W的弱 | |
| C. | X分别与Y、W形成的化合物中化学键类型相同 | |
| D. | Z是活泼的金属,其最高价氧化物对应的水合物为强碱 |
6.下列气体除杂所用试剂错误的是(括号内为杂质)( )
| A. | Cl2(HCl):饱和食盐水 | B. | H2(H2S、HCl、H2O):碱石灰 | ||
| C. | SO2(HCl):Na2SO3溶液 | D. | CO2(H2S):CuSO4溶液 |
7.下列说法不正确的是( )
| A. | 常温下,将CH3COONa溶液,盐酸混合后,溶液呈中性,则有c(Cl-)=c(CH3COOH) | |
| B. | 常温下将pH=2的硫酸和pH=12的氨水等体积混合,所得溶液的pH>7 | |
| C. | pH=3的醋酸溶液加水稀释后,溶液中c(CH3COO-)•c(H+)不变 | |
| D. | 向0.1 mol•L-1的Na2SO3溶液中加入少量NaOH固体,c(SO32-)与c(Na+)均增大 |

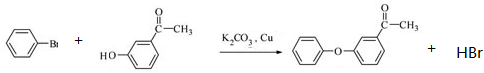 .
.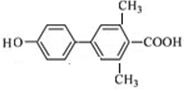 、
、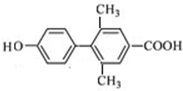 、
、 、
、 (其中一种).
(其中一种).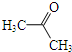 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: