题目内容
7.等质量的铁与过量的盐酸在不同的试验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到如图,则曲线a、b、c、d所对应的试验组别是( )| 组别 | c(HCl)(mol•L-1) | 温度(℃) | 铁的状态 | 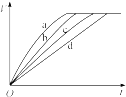 |
| 1 | 2.0 | 25 | 块状 | |
| 2 | 2.5 | 30 | 块状 | |
| 3 | 2.5 | 50 | 粉末状 | |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 3-4-2-1 | B. | 1-2-4-3 | C. | 4-3-2-1 | D. | 1-2-3-4 |
分析 等质量的铁与过量的盐酸反应,根据外界条件对反应速率的影响,反应物的浓度越大,实验温度越高,固体表面积越大,则反应速率越大.
解答 解:由图象可知,t越小用反应需要的时间越少,反应速率越快,则反应速率为a>b>c>d,由表中数据可知,从接触面积看:粉末状固体>块状固体,所以,粉末状固体化学反应速率快.从反应温度看:温度越高,化学反应速率越快.4组均为粉末状固体,且3的反应温度最高,所以3反应速率最快;3与2的反应温度相同,但2组为块状固体,故3快;1组既是块状固体,反应温度又最低,所以化学反应速率最慢,所以反应速率为3>4>2>1.
故选A.
点评 本题考查外界条件对反应速率的影响,为高频考点,侧重于学生的分析能力的考查,题目难度不大,本题注意把握影响化学反应速率的因素,学习中注重相关基础知识的积累.

练习册系列答案
相关题目
17.微生物燃料电池因具有原料广泛、操作条件温和、清洁高效和资源利用率高、无污染等特点而被人们所重视.以用葡萄糖作底物的燃料电池为例,其正负极反应式如下:
正极反应:6O2+24H++24e-$\frac{\underline{\;催化剂\;}}{\;}$12H2O 负极反应:C6H12O6+6H2O-24e-$\frac{\underline{\;催化剂\;}}{\;}$6CO2↑+24H+ 则有关该电池的下列说法正确的是( )
正极反应:6O2+24H++24e-$\frac{\underline{\;催化剂\;}}{\;}$12H2O 负极反应:C6H12O6+6H2O-24e-$\frac{\underline{\;催化剂\;}}{\;}$6CO2↑+24H+ 则有关该电池的下列说法正确的是( )
| A. | 该电池的工作环境是高温条件 | |
| B. | 作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原 | |
| C. | 该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等 | |
| D. | 该电池的总反应为C6H12O6+6O2$\frac{\underline{\;催化剂\;}}{\;}$6CO2+6H2O |
15.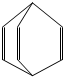 烯料是人们装修房屋时常用的物质,其中桶烯就是其中倍受青睐的一种,其结构简式如图所示,有关桶烯说法不正确的是( )
烯料是人们装修房屋时常用的物质,其中桶烯就是其中倍受青睐的一种,其结构简式如图所示,有关桶烯说法不正确的是( )
 烯料是人们装修房屋时常用的物质,其中桶烯就是其中倍受青睐的一种,其结构简式如图所示,有关桶烯说法不正确的是( )
烯料是人们装修房屋时常用的物质,其中桶烯就是其中倍受青睐的一种,其结构简式如图所示,有关桶烯说法不正确的是( )| A. | 不慎将桶烯撒倒地面瓷砖上,可用火烤干 | |
| B. | 1mol桶烯在一定条件下能与3molCl2发生加成反应 | |
| C. | 桶烯与苯乙烯互为同分异构体 | |
| D. | 桶烯可用做其它有机涂料的溶剂 |
12.下列关于乙醇的说法不正确的是( )
| A. | 乙醇分子中的官能团为羟基 | B. | 可由乙烯通过加成反应制取 | ||
| C. | 与丙三醇互为同系物 | D. | 通过取代反应可制取乙酸乙酯 |
19.镭是元素周期表中第七周期第ⅡA族元素,关于其叙述不正确的是( )
| A. | 镭的金属性比钙弱 | B. | 单质能与水反应生成氢气 | ||
| C. | 在化合物中呈+2价 | D. | 碳酸镭难溶于水 |
17.下列说法正确的是( )
| A. | pH=5的H2S溶液中,c(H+)=c(HS一)=1×10-5mol•L-1 | |
| B. | 含有AgCl和AgI固体的悬浊液中,c(Ag+)>c(Cl-)=c(I-) | |
| C. | 在新制氯水中加入氯化钠固体,水的电离平衡不移动 | |
| D. |  若R为Zn,则如图采用了牺牲阳极的阴极保护法 |
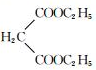 $→_{CH_{3}CH_{2}ONa}^{BrCH_{2}CH_{2}CH_{2}Br}$
$→_{CH_{3}CH_{2}ONa}^{BrCH_{2}CH_{2}CH_{2}Br}$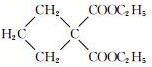 $→_{ii.H+/△}^{i.H_{2}O,OH-}$
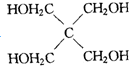
$→_{ii.H+/△}^{i.H_{2}O,OH-}$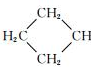 -COOH
-COOH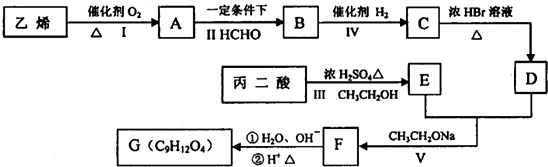
 G
G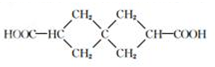
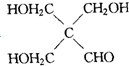
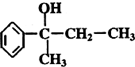 在工业上用基础的石油产品(乙烯、丙烯等)进行合成.合成A的过程可表示为:
在工业上用基础的石油产品(乙烯、丙烯等)进行合成.合成A的过程可表示为: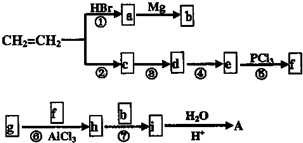

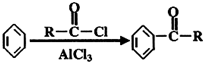
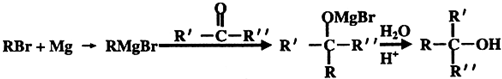
 ;
;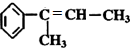 .
.