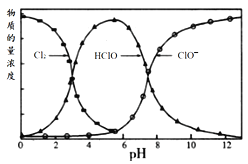
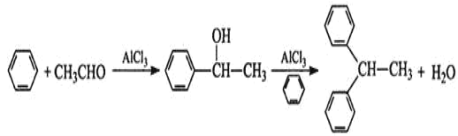
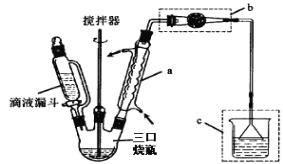
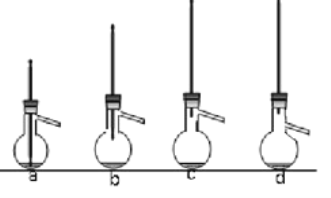
题目内容
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E是生活中最坚硬的金属。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E是生活中最坚硬的金属。回答下列问题:
(1)用元素符号表示D所在周期(除稀有气体元素外)电负性最大的元素是__;
(2)D的氢化物比C的氢化物的沸点__(填"高"或"低"),原因__;
(3)写出E元素的电子排布式__,已知元素周期表可按电子排布分为s区、p区等,则E元素在__区;
(4)A、B、C最高价氧化物的晶体类型是分别是___晶体,__晶体,__晶体;
(5)画出D的核外电子排布图___,这样排布遵循了__原理和___规则。
【答案】F 高 NH3分子间形成氢键 1s22s22p63s23p63d54s1 d 原子 离子 分子 ![]() 泡利 洪特
泡利 洪特
【解析】
A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,则A为Si,B是同周期第一电离能最小的元素,则B为Na,C的最外层有三个成单电子,故C为P,D为N,E是生活中最坚硬的金属,则E为Cr。
,则A为Si,B是同周期第一电离能最小的元素,则B为Na,C的最外层有三个成单电子,故C为P,D为N,E是生活中最坚硬的金属,则E为Cr。
⑴N是第二周期,因此所在周期(除稀有气体元素外)电负性最大的元素是F;故答案为:F。
⑵D的氢化物NH3比C的氢化物PH3的沸点高,原因氨气分子间形成氢键;故答案为:高;NH3分子间形成氢键。
⑶E为Cr是24号元素,其电子排布式1s22s22p63s23p63d54s1,因此Cr在d区;故答案为:1s22s22p63s23p63d54s1;d。
⑷A、B、C最高价氧化物分别是SiO2、Na2O、P2O5,因此其晶体类型是分别是原子晶体,离子晶体,分子晶体;故答案为:原子;离子;分子。
⑸N的核外电子排布图![]() ,这样排布遵循了泡利原理和洪特规则;故答案为:
,这样排布遵循了泡利原理和洪特规则;故答案为:![]() ;泡利;洪特。
;泡利;洪特。

 智慧小复习系列答案
智慧小复习系列答案【题目】化学与社会、生活密切相关,对下列现象或事实的解释不正确的是( )
选项 | 现象或事实 | 解释或对应的离子方程式 |
A | 用热的纯碱溶液洗去油污 | CO32-+H2O 溶液呈碱性,温度升高碱性增强 |
B | 酸雨样品在空气中放置pH减小 | SO2+H2O=H2SO3 |
C | 用泡沫灭火器灭火 | Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
D | 用加热法除去NaCl固体中混有的NH4Cl固体 | NH4Cl固体在加热条件下可以完全分解成为气体而除去 |
A.AB.BC.CD.D