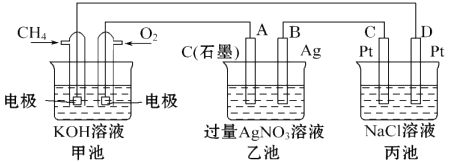
题目内容
【题目】在80℃时,将0.40 mol的N2O4气体充入2 L已经抽成真空的固定容积的密闭容器中,发生反应N2O4(g)![]() 2NO2(g),隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g),隔一段时间对该容器内的物质进行分析,得到如下数据:
| 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0. 20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40 s内用N2O4表示的平均反应速率为 ___________mol L-1·s-1
(2)计算在80℃时该反应的平衡常数K =____________(请注明单位)。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”“变深”或“不变)。
(4)要增大该反应的K值,可采取的措施有_________(填字母代号)
A.增大N2O4起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
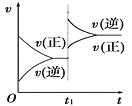
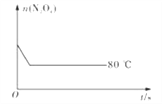
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线_________。
【答案】 0.0020 1.8mol·L-1 变浅 D 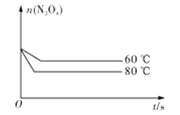
【解析】试题分析:(1)N2O4的速率=(0.40-0.20)mol÷2L÷20s=0.0020 mol·L-1·s-1;(2) 根据方程式:N2O4![]() 2NO2
2NO2
初始物质的的量 0.4 0
改变物质的量 x 2x
平衡物质的量 0.4-x 0.6 列式计算 2x=0.6 x=0.3 平衡时N2O4的物质的量为0.4-0.3=0.1mol,平衡常数=c(NO2)2÷c(N2O4)=(0.6÷2)2÷(0.1÷2)=1.8 mol·L-1;(3)降低温度,平衡向放热方向移动,故向逆向移动,二氧化氮浓度减小,颜色变浅;(4)化学平衡常数只有温度有关,升温,平衡正向移动,化学平衡常数增大;(5)反应在60℃时,反应速率减慢,N2O4物质的量变化缓慢,达到平衡所需要的时间长,温度低有利于平衡逆向移动,N2O4物质的量比80℃时的多,故画图为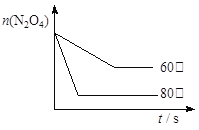

【题目】如表是元素周期表的一部分,按要求填空( 填元素符号或化学式):
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)写出①元素的元素名称 .
(2)写出⑩元素的元素符号 .
(3)⑨在元素周期表中的位置:第周期,第族.
(4)在这些元素中,是最活泼的金属元素;是最活泼的非金属元素;是最不活泼的元素.(用元素符号填写)
(5)能形成气态氢化物,且气态氢化物最稳定的是 . (用化学式填写)
(6)这些元素的最高价氧化物对应水化物中最强的酸是;最强的碱是;具有两性的氢氧化物是 . (用化学式填写)
(7)从⑤到的元素中,原子半径最小.(用元素符号填写)
(8)比较⑤与⑥的化学性质,更活泼(用元素符号填写),试用实验证明此现象(简述实验操作、现象和结论) .
(9)用电子式表示元素④与⑥形成的化合物: , 该化合物属于(填“共价”或“离子”)化合物.