题目内容
【题目】如图是一个化学过程的示意图,回答下列问题: 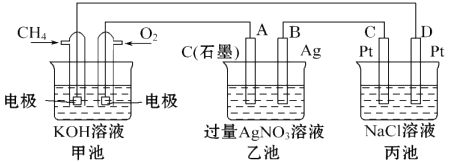
(1)甲装置中通入CH4的电极反应式为 ,
(2)从能量转化的角度分析,乙池是转化为的装置.
(3)一段时间,当丙池中产生112mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的物质的量浓度为 . (己知:NaCl溶液足量,电解后溶液体积为500mL).
(4)若要使丙池恢复电解前的状态,应向丙池中通入(写化学式).
【答案】
(1)CH4+10OH﹣﹣8e﹣?CO3 2﹣+7H2O
(2)电能;化学能
(3)0.01mol/L
(4)HCl
【解析】解:(1.)甲是原电池,通入甲烷的电极是负极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4+10OH﹣﹣8e﹣CO3 2﹣+7H2O,所以答案是:CH4+10OH﹣﹣8e﹣CO3 2﹣+7H2O;
(2.)乙池是电解池,将电能转化为化学能,所以答案是:电能;化学能;
(3.)丙池是电解池,C电极生成氯气、D电极生成氢气,且生成氯气和氢气物质的量之比为1:1,生成氯气物质的量= ![]() =0.0025mol,根据氯气和NaOH关系式得n(NaOH)=2n(Cl2)=2×0.0025mol=0.005mol,则电解后c(NaOH)═
=0.0025mol,根据氯气和NaOH关系式得n(NaOH)=2n(Cl2)=2×0.0025mol=0.005mol,则电解后c(NaOH)═ ![]() =0.01mol/L,所以答案是:0.01mol/L;
=0.01mol/L,所以答案是:0.01mol/L;
(4.)阳极上生成氯气、阴极上生成氢气,相当于析出氯化氢,根据析出什么加入什么原则知,通入HCl气体能使溶液恢复原状,所以答案是:HCl.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:
X(g)+ 3Y(g) ![]() 2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
选项 | 改变条件 | 新平衡与原平衡比较 |
A | 升高温度 | X的转化率变小 |
B | 增大压强 | X的浓度变小 |
C | 充入一定量Y | Y的转化率增大 |
D | 使用适当催化剂 | X的体积分数变小 |
A. A B. B C. C D. D
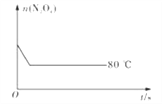
【题目】在80℃时,将0.40 mol的N2O4气体充入2 L已经抽成真空的固定容积的密闭容器中,发生反应N2O4(g)![]() 2NO2(g),隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g),隔一段时间对该容器内的物质进行分析,得到如下数据:
| 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0. 20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40 s内用N2O4表示的平均反应速率为 ___________mol L-1·s-1
(2)计算在80℃时该反应的平衡常数K =____________(请注明单位)。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”“变深”或“不变)。
(4)要增大该反应的K值,可采取的措施有_________(填字母代号)
A.增大N2O4起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线_________。