题目内容
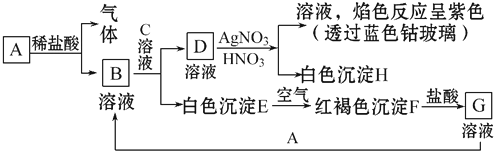
20.已知A、B、C、D、E、F是含有同一种元素的化合物,其中A是红综色气体,B是无色气体,F是能使湿润红色石蕊试纸变蓝的气体,它们之间能发生如下反应:①A+H2O→B+C ②C+F→D ③D+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$F+E+H2O
(1)写出它们的化学式:ANO2、BNO、CHNO3、DNH4NO3、ECa(NO3)2、FNH3;
(2)写出各步反应的化学方程式,并指出反应①的氧化剂和还原剂.
①3NO2+H2O=2HNO3+NO,氧化剂NO2、还原剂NO2.
②HNO3+NH3=NH4NO3.
③2NH4NO3+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$Ca(NO3)2+2NH3↑+2H2O.
分析 A是红综色气体,则A为NO2,A+H2O→B+C,B是无色气体,B是NO,C是HNO3,F是能使湿润红色石蕊试纸变蓝的气体,F是NH3,A、B、C、D、E、F是含有同一种元素的化合物,C+F→D,则D是NH4NO3,D+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$F+E+H2O,E为NaNO3,根据物质的性质分析解答.
解答 解:A是红综色气体,则A为NO2,A+H2O→B+C,B是无色气体,B是NO,C是HNO3,F是能使湿润红色石蕊试纸变蓝的气体,F是NH3,A、B、C、D、E、F是含有同一种元素的化合物,C+F→D,则D是NH4NO3,D+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$F+E+H2O,E为Ca(NO3)2,
(1)由上述分析,A为NO2,B为NO,C为HNO3,D为NH4NO3,E为Ca(NO3)2,F为NH3,
故答案为:NO2;NO;HNO3;NH4NO3;Ca(NO3)2;NH3;
(2)①二氧化氮和水反应生成一氧化氮和硝酸,化学方程式为:3NO2+H2O=2HNO3+NO,该反应中N元素化合价由+4价变为+2价和+5价,所以此反应中氧化剂NO2,还原剂是NO2,
故答案为:3NO2+H2O=2HNO3+NO;NO2;NO2;
②为硝酸与氨气反应,方程式为HNO3+NH3=NH4NO3,故答案为:HNO3+NH3=NH4NO3;
③为硝酸铵与氢氧化钙反应,方程式为2NH4NO3+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$Ca(NO3)2+2NH3↑+2H2O,故答案为:2NH4NO3+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$Ca(NO3)2+2NH3↑+2H2O.
点评 本题以N元素为载体考查了含氮化合物的推断,以F为突破口结合物质间的转化分析推断,难度不大,注意多总结归纳基础知识,知道常见物质的性质.

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案| A. | 浓硫酸的稀释 | B. | 铝热反应 | ||
| C. | 氢气还原氧化铜 | D. | 氢氧化钡晶体与氯化铵晶体混合 |
| A. | 1 mol O2与Na完全反应,转移电子数一定为4NA | |
| B. | 常温常压下,1.7克NH3中含有共价键的数目为NA | |
| C. | 142g Na2SO4和Na2HPO4混合物中含有的阴、阳离子总数是3 NA | |
| D. | 标准状况下,11.2 L SO3所含的分子数目为0.5NA |
| A. | 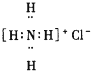 | B. | 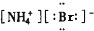 | C. | 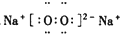 | D. | 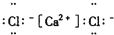 |
| A. | 钠与硫酸铜溶液反应会置换出红色的铜 | |
| B. | 常温下干燥氯气与铁不反应,可以用钢瓶储存液氯 | |
| C. | CO2、NO2、SO2都能与H2O反应,其反应原理相同 | |
| D. | C、N、S三种单质直接与O2反应都能生成两种氧化物 |
| A. | X的金属性比Y的金属性强 | |
| B. | 常温下,X和Y都不能从水中置换出氢 | |
| C. | Y元素的氢氧化物碱性比X元素的氢氧化物碱性大 | |
| D. | X元素的最高化合价比Y元素的最高化合价低 |