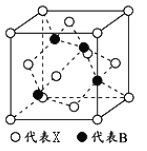
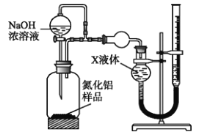
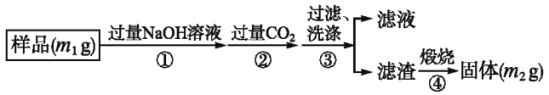
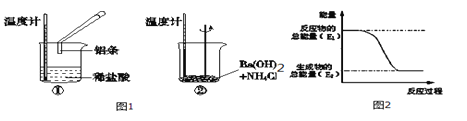
题目内容
【题目】CH3COOH的电离方程式为CH3COOH![]() CH3COO-+H+。在0.1 mol·L-1醋酸中加入下列物质,醋酸的电离平衡及平衡时物质的浓度的变化:
CH3COO-+H+。在0.1 mol·L-1醋酸中加入下列物质,醋酸的电离平衡及平衡时物质的浓度的变化:
(1)向醋酸中加入醋酸钠固体,电离平衡 移动(填“向左”“向右”或“不”,下同);c(H+) (填“增大”“减小”或“不变”,下同),pH 。
(2)向醋酸中加入碳酸钙固体,电离平衡向 移动;c(CH3COOH) 。
(3)向醋酸中加入大量的水,c(OH-) 。导电能力 ,电离平衡常数 。
【答案】(1)向左、减小 、增大;(2)向右 、减小;(3)增大 、减小 、不变
【解析】
试题分析:(1)醋酸是弱电解质,电离方程式为CH3COOH![]() CH3COO-+H+,加入醋酸钠固体,醋酸钠是强电解质,电离出CH3COO-,CH3COO-浓度增大,平衡逆向移动,c(H+)减小,则PH增大;
CH3COO-+H+,加入醋酸钠固体,醋酸钠是强电解质,电离出CH3COO-,CH3COO-浓度增大,平衡逆向移动,c(H+)减小,则PH增大;
(2)向醋酸中加入碳酸钙固体,碳酸钙和醋酸反应CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑,反应的本质为碳酸根离子和乙酸电离出的氢离子反应,所以CH3COOH的电离平衡向右移动,c(CH3COOH)减小;
(3)浓度越稀,电离程度越大,醋酸溶液中加水稀释,促进电离,电离平衡向正向移动,溶液中离子的数目增多,但c(H+)减小,则c(OH-)增大,导电能力与离子浓度有关,c(H+)减小,导电能力减弱,由于温度不变,则电离平衡常数不变。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目