题目内容
【题目】二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。
(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为___________________________;向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是 。
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
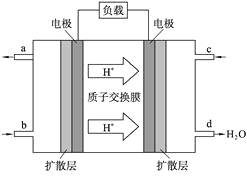
(3)电解法是目前研究最为热门的生产ClO2的方法之一。如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。
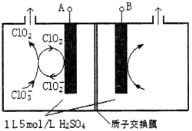
①电源负极为___________________极(填A或B)
②写出阴极室发生反应的电极反应式和离子方程式
_______________________ ___ ; 。
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2—歧化反应。若两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),此时阳极室与阴极室c(H+)之差为_________________。
【答案】(1)5ClO2-+4H+=4ClO2↑+Cl-+2H2O ;反应生成的Cl-对反应起催化作用 ;
(2)H2O2做还原剂时氧化产物为O2,而盐酸则产生大量Cl2;
(3) ①A;②ClO2+e-= ClO2- ;ClO3-+ ClO2-+2H+= 2ClO2↑+ H2O;③ 0.8mol/L
【解析】
试题分析:(1)亚氯酸钠在强酸性溶液中会发生歧化反应,产生ClO2气体,根据题意,结合原子守恒、电子守恒及电荷守恒的知识可得该反应的离子方程式为5ClO2-+4H+=4ClO2↑+Cl-+2H2O。在pH相同的盐酸中的反应速率比硫酸中快,说明溶液中的Cl-可能会影响化学反应速率;一段时间后在硫酸中的反应速率也加快,这是由于发生反应5ClO2-+4H+=4ClO2↑+Cl-+2H2O,随着反应的进行,溶液中Cl-的浓度增大了,所以产生气体速率迅速加快的原因是反应生成的Cl-对反应起催化作用。
(2)用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是H2O2做还原剂时氧化产物为O2,而盐酸则产生大量Cl2;O2是大气的成分,而Cl2是大气污染物,会对环境造成危害。
(3)①根据题图中物质所含元素的化合价的变化情况可以看出:A电极所连接的电极发生还原反应,是电解池的阴极,所以A为电源的负极,B为电源的正极。
②根据题图可知阴极室发生反应依次为ClO2+e-= ClO2- ;ClO3-+ ClO2-+2H+= 2ClO2↑+ H2O。
③在整个闭合回路中电子转移数目相等。阴极室每产生4mol的ClO2电子转移4mol,同时在阳极室发生反应:4OH--4e-=2H2O+ O2↑,产生1mol的O2。因此转移4mol电子,一共产生5mol气体。现在产生气体的物质的量为1mol,所以转移电子0.8mol,在阳极有0.8mol的OH-离子放电,因为溶液的体积为1L。所以此时阳极室与阴极室c(H+)之差为0.8mol/L。

【题目】甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
反应 | 化学方程式 | 焓变△H | 正反应活化能Ea |
甲烷 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
蒸汽 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
回答下列问题:
(1)反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H= kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)KP的表达式为 ;随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
CO(g)+3H2(g)KP的表达式为 ;随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量角度分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
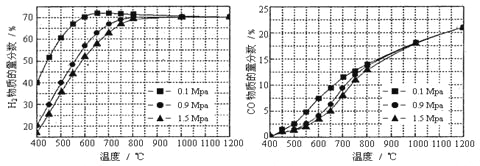
①若要达到H2物质的量分数>65%/span>、CO的物质的量分数<10%,以下条件中最合适的是 。
A.600℃,0.9Mpa B.700℃,0.9Mpa C.800℃,1.5Mpa D.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。