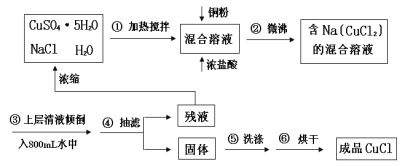
题目内容
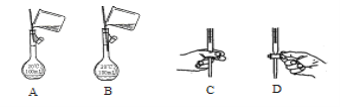
【题目】用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是.( )
A.④③⑦⑤⑥;B.②⑤⑦⑥;C.①③⑤⑥⑦;D.②⑥③⑦⑤⑥
【答案】D
【解析】
浓硫酸的浓度为![]() =18.4mol/L,根据溶液稀释过程中溶质的量是不变的规律可知,VmL×18.4mol/L=100 mL× l mol/L,V=5.4mL,因此应该选择10mL量筒;据此进行分析。
=18.4mol/L,根据溶液稀释过程中溶质的量是不变的规律可知,VmL×18.4mol/L=100 mL× l mol/L,V=5.4mL,因此应该选择10mL量筒;据此进行分析。
结合以上分析可知,实验步骤是:用10 mL量筒量取5.4mL的浓硫酸,在烧杯中稀释后,转移到100 mL容量瓶中,洗涤烧杯、玻璃棒并把洗涤液移入容量瓶,加水定容,震荡摇匀,按使用仪器的先后顺序排列为②10 mL量筒、⑥胶头滴管、③50 mL烧杯、⑦玻璃棒、⑤100 mL容量瓶、⑥胶头滴管,故选D。

练习册系列答案
相关题目