题目内容
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5 、+3、 -3 | -2 |
下列-叙述正确的是
A.X、Y元素的金属性X<Y
B.Z的气态氢化物比W的气态氢化物稳定
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.X能在Z 的单质中燃烧
D
解析试题分析:W化合价为-2价,没有最高正化合价+6价,W为氧元素;Z元素化合价为+5、+3、-3,Z处于ⅤA族,原子半径与氧元素相差不大,则Z与氧元素处于同一周期,则Z为氮元素;X化合价为+2价,应为周期表第ⅡA族,Y的化合价为+3价,应为周期表第ⅢA族元素,二者原子半径相差较小,可知两者位于同一周期相邻主族,由于X、Y的原子半径与W、Z原子半径相差很大,则X、Y应在第三周期,所以X为镁元素,Y为铝元素。
A、同周期自左而右,金属性减弱,所以X、Y元素的金属性X>Y,故A错误;
B、氮元素的非金属性弱于氧元素的,非金属性越强,氢化物的温度下越强,则氨气的温度下弱于水的,故B错误;
C、Y的最高价氧化物的水化物是氢氧化铝,属于两性氢氧化物,但不能溶于弱碱氨水中,故C错误;
D、镁在氮气中燃烧,生成氮化镁,故D正确,答案选D。
考点:考查元素位置、结构和性质的关系及应用
点评:该题是中等难度的试题,也是高考中的常见题型。试题针对性强,侧重考查学生灵活运用元素周期律解决实际问题的能力的培养。答题时从原子半径的变化和元素的最高正价和最低负价入手寻求突破,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键。

 科学实验活动册系列答案
科学实验活动册系列答案X、Y、Z为短周期非金属元素,其相关性质如下:
| 元素 | X | Y | Z |
| 与H2反应条件 | 暗处反应 | 光照 | 高温、催化剂 |
| 常温下氢化物水溶液的pH | 小于7 | 小于7 | 大于7 |
A.非金属性X<Y
B.Z为第VA族元素
C.最外层电子数Z>Y
D.Y、Z的氢化物反应形成离子化合物
关于原子结构、元素性质的说法正确的是
| A.随原予序数的递增,元素原子的核外电子数增多,原子半径逐渐减小 |
| B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素 |
| C.若两种元素原子的最外层电子数相同,则元素最高正价一定相同 |
| D.电子层结构相同的微粒,其化学性质一定相似 |
X元素的阳离子和Y元素的阴离子具有与氖原子相同的电子层结构,下列说法正确的是
| A.原子序数X<Y | B.原子半径X>Y |
| C.原子的最外层电子数X>Y | D.元素的最高正价X<Y |
下列不能说明氯的非金属性比硫强的事实是 ( )
①HCl比H2S稳定 ②HCl和H2S的水溶液前者的的酸性强
③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S
⑤Cl原子能得1个电子变成稳定离子而S原子能得两个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
| A.①②④ | B.① ②⑥ | C.②⑤ | D.①③⑤ |
下列离子中,与Na+含有相同电子数的是
| A.F- | B.Cl- | C.Br- | D.I- |
元素X、Y的原子在化学反应中都易失去电子而形成与Ne相同的电子层结构,已
知X的原子序数比Y的原子序数大,下列说法中正确的是
| A.X的金属性比Y的金属性强 |
| B.常温下,X和Y都不能从水中置换出氢 |
| C.X元素的最高化合价比Y元素的最高化合价低 |
| D.Y元素的氢氧化物碱性比X元素的氢氧化物碱性强 |
下列各组性质比较中,正确的是
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③非金属性:F>C>O ④氧化性:Li+﹤Na+﹤K+
⑤气态氢化物沸点:HF>HCl
| A.①②③ | B.②③④ | C.①②⑤ | D.①②④⑤ |
短周期元素ZW的某种微粒的结构示意图如下,下列说法一定不正确的是( )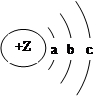
| A.Z=a+b+c | B.若Z<a+b+c,该微粒一定是原子 |
| C.c≤b=8 | D.若c=b,该微粒可能原子或阴离子 |