题目内容
短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是( )
| A.原子半径:W>X>Z>Y | B.热稳定性:H2Y>HZ |
| C.离子半径:W2+>Y2- | D.碱性:XOH>W(OH)2 |
D
解析试题分析:aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,则一定满足关系式a-2=b-1=c+2=d+1。其中W和X属于金属,位于同一周期,且W在X的右侧。Y和Z是非金属,位于同一周期,且位于W和X的上一周期,其中Z位于Y的右侧。同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强,最高价氧化物的水化物的碱性逐渐减弱,氢化物的稳定性逐渐增强,所以选项AB都是错误的,D正确。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,则离子半径:W2+<Y2-,选项C不正确,答案选D。
考点:考查核外电子排布以及元素周期律的应用
点评:该题是中等难度的试题,也高考中的常见题型。试题贴近高考,侧重对学生能力的培养。该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

下图是部分短周期主族元素原子半径与原子序数的关系图,下列说法正确的是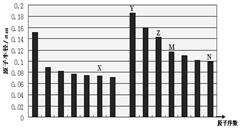
| A.非金属性:X>N |
| B.气态氢化物的稳定性:M<N |
| C.X和Y形成的化合物中只可能含离子键 |
| D.化合物MX2能与碱反应,不能与任何酸反应 |
X元素的阳离子和Y元素的阴离子具有与氖原子相同的电子层结构,下列说法正确的是
| A.原子序数X<Y | B.原子半径X>Y |
| C.原子的最外层电子数X>Y | D.元素的最高正价X<Y |
下列离子中,与Na+含有相同电子数的是
| A.F- | B.Cl- | C.Br- | D.I- |
元素X、Y的原子在化学反应中都易失去电子而形成与Ne相同的电子层结构,已
知X的原子序数比Y的原子序数大,下列说法中正确的是
| A.X的金属性比Y的金属性强 |
| B.常温下,X和Y都不能从水中置换出氢 |
| C.X元素的最高化合价比Y元素的最高化合价低 |
| D.Y元素的氢氧化物碱性比X元素的氢氧化物碱性强 |
与元素的化学性质关系最密切的是( )。
| A.质子数 | B.中子数 | C.核电荷数 | D.最外层电子数 |
下列各组性质比较中,正确的是
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③非金属性:F>C>O ④氧化性:Li+﹤Na+﹤K+
⑤气态氢化物沸点:HF>HCl
| A.①②③ | B.②③④ | C.①②⑤ | D.①②④⑤ |
a、b、c、d、e是第三周期的五种元素,a和b的最高价氧化物的水化物显碱性,且碱性b>a,c和d的气态氢化物的稳定性c>d,e的单质既能与氢氧化钠溶液反应,也能与稀硫酸反应,并且都产生氢气,则它们的原子序数由小到大的顺序是
| A.a、b、e、d、c | B.b、a、c、e、d |
| C.b、a、e、d、c | D.b、a、d、c、e |
目前,医疗上使用放射性核素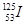 治疗肿瘤,该核素原子核内的中子数与电子数之差是
治疗肿瘤,该核素原子核内的中子数与电子数之差是
| A. 125 | B.72 | C.19 | D.53 |