题目内容
下图是短周期元素原子半径与最外层电子数的关系图,其中乙单质是半导体,下列说法正确的是( )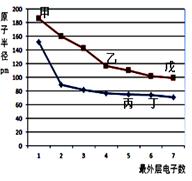
| A.丙的氢化物与丙的最高价氧化物的水化物能发生化合反应 |
| B.气态氢化物的稳定性:丙>丁>戊 |
| C.甲的离子半径比丁的简单离子半径小 |
| D.乙与丁形成的化合物含共价键,同时是两性氧化物 |
AC
解析试题分析:单质硅是半导体,则乙是硅;以此为突破口,图中与硅同周期且原子最外层电子数为1的甲是钠,原子最外层电子数为7的戊是氯;硅的上一周期且原子最外层电子数为5的丙是氮,原子最外层电子数为6的丁是氧。丙是氮,氮的氢化物是氨气,氮的最高价氧化物的水化物是硝酸,氨气与硝酸容易发生化合反应,生成硝酸铵,故A正确;丙、丁、戊分别是氮、氧、氯,氧无最高正价,合成氨是可逆反应,氢气与氯气反应是不可逆反应,则非金属性:N<Cl<O,非金属性越强,气态氢化物越稳定,则NH3<HCl<H2O,故B错;甲、丁分别是钠、氧,核电荷数分别是11、8,钠离子和氧离子都具有28电子层结构,电子层数相同,核电荷数越大,离子半径越小,则钠离子半径小于氧离子半径,故C正确;乙、丁分别是硅、氧,都是非金属,二者以共价键形成的化合物是二氧化硅,二氧化硅是酸性氧化物,不是两性氧化物,故D错。
考点:考查物质结构和元素周期律,涉及元素在周期表的位置、物质结构、元素及其化合物的主要性质的综合推断等。

练习册系列答案
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
X、Y、Z为短周期非金属元素,其相关性质如下:
| 元素 | X | Y | Z |
| 与H2反应条件 | 暗处反应 | 光照 | 高温、催化剂 |
| 常温下氢化物水溶液的pH | 小于7 | 小于7 | 大于7 |
A.非金属性X<Y
B.Z为第VA族元素
C.最外层电子数Z>Y
D.Y、Z的氢化物反应形成离子化合物
下图是部分短周期主族元素原子半径与原子序数的关系图,下列说法正确的是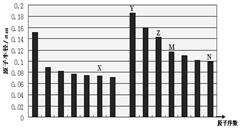
| A.非金属性:X>N |
| B.气态氢化物的稳定性:M<N |
| C.X和Y形成的化合物中只可能含离子键 |
| D.化合物MX2能与碱反应,不能与任何酸反应 |
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如下图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的
| | | X | Y |
| Z | W | | |
A.Y元素最高价氧化物对应的水化物化学式为H3YO4
B.原子半径由小到大的顺序为:X<Z<Y<W
C.与同浓度的盐酸反应,Z比W更剧烈
D.X的氧化物不能与Z单质反应
同主族常见的三种元素X、Y、Z,它们最高价氧化物对应水化物的酸性强弱顺序为HXO4<HYO4<HZO4,下列判断不正确的是
| A.单质氧化性:Y>Z | B.离子半径:X->Y- |
| C.气态氢化物稳定性:HX<HZ | D.Y单质可以在海水中提取 |
关于原子结构、元素性质的说法正确的是
| A.随原予序数的递增,元素原子的核外电子数增多,原子半径逐渐减小 |
| B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素 |
| C.若两种元素原子的最外层电子数相同,则元素最高正价一定相同 |
| D.电子层结构相同的微粒,其化学性质一定相似 |
X元素的阳离子和Y元素的阴离子具有与氖原子相同的电子层结构,下列说法正确的是
| A.原子序数X<Y | B.原子半径X>Y |
| C.原子的最外层电子数X>Y | D.元素的最高正价X<Y |