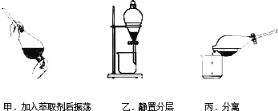
��Ŀ����
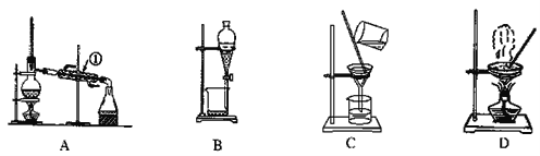
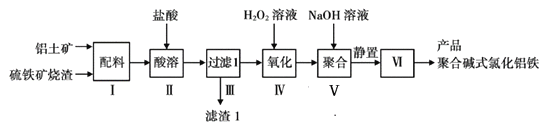
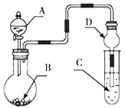
����Ŀ����һ�������Ͻ𣬼��뵽��������������Һ���˳�������ϴ�Ӻ�����һ��������ǡ����ȫ�ܽ⣬��������Һ�м���������ˮ���ڿ����о��������ɫ������������Ϊֹ���������˳������������أ��õ����� �����������ԭ�Ͻ��������ͬ����
��1���Ͻ�������������������Һ������Һ�к��е���������______ ��_______ ��
��2�������˳������������أ��õ���������Ļ�ѧʽΪ____________________��
��3���Ͻ���������������Ϊ__________ ��
���𰸡�![]()
![]()
![]() 30%
30%
��������
�������Ͻ𣬼��뵽��������������Һ������Ӧ����Ƭ����Ӧ������2Al ��2OH����2H2O == 2AlO2����3H2����Ӧ�������Һ����ƫ��������ӣ������������ƹ�������˻�ʣ�����������ӣ��ʴ�ΪAlO2����OH����
���˳������T����ϴ�Ӻ�����һ��������ǡ����ȫ�ܽ⣬�������ᷴӦ�����Ȼ���������������Һ�м���������ˮ������Һ�������������������ڿ����о��������ɫ������������Ϊֹ����������������������Ϊ�����������������˳������������أ������������ȷֽ�Ϊ���������ʴ�ΪFe2O3��
�Ǹ������⣬������������������������������ȣ������������غ㶨�ɵó����������͵�����������������������������������ʵ����������������������������
![]() ���ʴ�Ϊ30%��
���ʴ�Ϊ30%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����1����һ�������°����������ܷ�����Ӧ���ɵ�����ˮ������4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ��H
�������Ͽɵ��йصĻ�ѧ�������������£�
��ѧ�� | N��N | H��O | N��H | O=O |
E/ (kJ��mol��1) | 946 | 463 | 391 | 496 |
�ɴ˼���������Ӧ�ķ�Ӧ����H=___________kJ��mol��1��
��2����֪��N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
ע��K1��K2��K3�ֱ�Ϊ����������Ӧ��ƽ�ⳣ��
�ش��������⣺
�ٰ���������Ӧ(������̬ˮ)��ƽ�ⳣ��KΪ___________(��K1��K2��K3��ʾ)��
��һ�������£���4molNH3��5.2molO2������ݻ�Ϊ4L�ĺ����ܱ������з�����������Ӧ������10s��ﵽƽ�⣬���NO��Ũ��Ϊ0.4mol/L��0��10s�ڣ���NH3��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ___________��O2��ת����Ϊ___________(�ðٷ�����ʾ���ұ���С�����һλ)���÷�Ӧ��ƽ�ⳣ��Ϊ___________(�г�����ʽ����)��
����������Ӧ��һ�δﵽƽ��ʱ�����������������������£�ֻ�ǽ��������������һ�����ٶ���25s��ﵽ�µ�ƽ�⡣������ͼ�������߱�ʾ15~30s�������ϵ��NH3��Ũ����ʱ��仯�����ơ�__________

��3�������йظ÷�Ӧ��˵����ȷ����___________(����ĸ)��
A.���º��ݣ��ٳ���4molNH3��5.2molO2���ٴδﵽƽ��ʱ��NH3��ת��������
B.���º��ݣ��������ڵ��ܶȱ��ֲ���ʱ����Ӧ�ﵽ��ƽ��
C.����������ƽ��Ħ����������ʱ����Ӧ�ﵽ��ƽ��
D.��2v��(NO)=3v��(H2O)ʱ����Ӧ�ﵽ��ƽ��
��4����ҵ�ϳ��ð�ˮ����SO2��������(NH4)2SO3�����жϳ�����(NH4)2SO3��Һ������Բ�ͨ������˵���ж����ݣ�_______________________________________________________��(��֪��NH3��H2O��Kb=1.8��10��5��H2SO3��Ka1=1.3��10��2��Ka2=6.3��10��8)