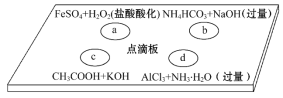
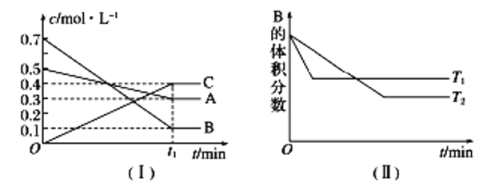
题目内容
【题目】化学兴趣小组利用下图装置进行铁与水的反应的实验,并利用产物制取 FeCl36H2O 晶体。(图中的部 分装置略去)
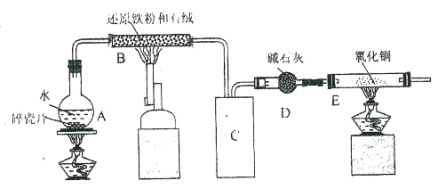
(1)A 中的碎瓷片的作用是_____,B 中发生反应的化学方程式为__________________。
(2)E 装置中的现象是_____。
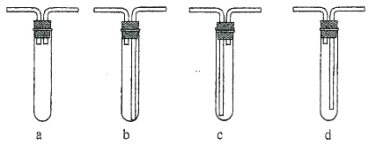
(3)C 装置应该是下列的(________)
(4)反应一段时间后,冷却并取出 B 中的固体,与过量的稀盐酸充分反应后(________)
(a)一定存在![]() (b)一定存在
(b)一定存在 ![]()
(c)可能存在![]() (d)
(d) ![]() 或
或![]() 只存在一种。
只存在一种。
(5)检验其中无![]() 的方法是_____。
的方法是_____。
(6)将上述溶液过滤:滤液![]() 溶液
溶液 ![]() 氯化铁晶体。步骤(I)通入 Cl2 的作用是_____,步骤(II)从较稀的溶液中得到晶体的主要操作包括_____,在此过程中保持盐酸稍过量的原因是_____。
氯化铁晶体。步骤(I)通入 Cl2 的作用是_____,步骤(II)从较稀的溶液中得到晶体的主要操作包括_____,在此过程中保持盐酸稍过量的原因是_____。
【答案】防止暴沸 ![]() 黑色粉末逐渐变红,管口有水珠生成 c bc 取样,向其中加入 KSCN 溶液,溶液不变红则无
黑色粉末逐渐变红,管口有水珠生成 c bc 取样,向其中加入 KSCN 溶液,溶液不变红则无 ![]() 将
将![]() 氧化成
氧化成![]() 蒸发浓缩、冷却结晶、过滤 抑制
蒸发浓缩、冷却结晶、过滤 抑制![]() 水解
水解
【解析】
⑴A主要是提供B中反应的水蒸气,加热液体水时要注意防暴沸,因此要加碎瓷片,故答案为防止暴沸;
B中是水蒸气和铁在高温条件下反应,发生反应的化学方程式为3Fe +4H2O(g)![]() Fe3O4+4H2,故答案为3Fe +4H2O(g)
Fe3O4+4H2,故答案为3Fe +4H2O(g)![]() Fe3O4+4H2;石棉绒的作用是增大接触面积,是反应更充分;
Fe3O4+4H2;石棉绒的作用是增大接触面积,是反应更充分;
⑵B装置生成氢气,E装置是氢气还原氧化铜的实验,即看到E装置中的现象是黑色粉末逐渐变红,管口有水珠生成;即答案为黑色粉末逐渐变红,管口有水珠生成;
⑶C装置的主要作用是起缓冲、冷却气流,使气体中的水冷凝,开始冷凝的水更好的冷凝后面的水蒸气,且冷凝水不能堵塞产生的氢气导气管,因此c正确,故答案为c;
⑷反应一段时间后,冷却并取出 B 中的固体,B中一定有四氧化三铁可能有没有反应的铁,四氧化三铁与过量的稀盐酸充分反应生成亚铁离子和铁离子,没有反应的铁与铁离子要反应,因此铁离子可能被反应完,也可能没有反应完,而亚铁离子一定有;故bc正确;
⑸检验其中无Fe3+的方法是取少量溶液于试管中,向其中加入KSCN溶液,溶液不变红则无Fe3+,反之则含有Fe3+,故答案取少量溶液于试管中,向其中加入KSCN溶液,溶液不变红则无Fe3+,反之则含有Fe3+;
⑹将上述溶液过滤:滤液![]() 溶液
溶液![]() 氯化铁晶体。步骤(I)通入Cl2的作用是将溶液中的亚铁离子氧化成铁离子,故答案为将Fe2+氧化成Fe3+;
氯化铁晶体。步骤(I)通入Cl2的作用是将溶液中的亚铁离子氧化成铁离子,故答案为将Fe2+氧化成Fe3+;
步骤(II)从较稀的溶液中得到晶体的操作是在氯化氢气流中蒸发浓缩、冷却结晶、过滤洗涤干燥,故答案为蒸发浓缩、冷却结晶、过滤,加入氯化氢或盐酸主要目的是抑制氯化铁水解,故答案为抑制FeCl3水解。