题目内容
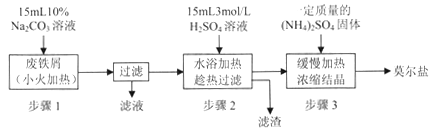
【题目】一种用铝土矿和硫铁矿烧渣(配料中含Al2O3、Fe2O3、FeO及SiO2等)为原料制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如下:

(提示:SiO2为难溶于盐酸的固体)
(1)配料中属于两性氧化物的是_________________,步骤Ⅱ酸溶时,Al2O3被溶解的离子方程式为___________________________________。
(2)“滤渣1”的主要成分为________(填化学式)。
(3)步骤Ⅳ加入H2O2溶液的目的是__________,发生反应的离子方程式为____________。
(4)步骤Ⅴ加入适量NaOH溶液发生反应生成聚合碱式氯化铝铁,若NaOH过量,可能造成的影响是_________;步骤Ⅵ包含的操作有________、洗涤、干燥。
(5)测定聚合碱式氯化铝铁[FeaAlb(OH)xCly]n中n(Fe)/n(Al)的比值的步骤如下:
步骤1:准确称取产品5.7100g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.3500g固体。
步骤2:另准确称取相同质量样品,溶于足量NaOH溶液,过滤,充分洗涤,将滤渣灼烧至质量不再变化,得到固体0.8000g。
计算产品中![]() 的比值为____________。
的比值为____________。
【答案】Al2O3 Al2O3+ 6H+=2Al 3++3H2O SiO2 把溶液中的亚铁离子氧化为铁离子 2Fe2++ H2O2+2H+= 2Fe3++2H2O 得到的是Fe(OH)3和NaAlO2,产率降低 过滤 1:5
【解析】
铝土矿和硫铁矿烧渣酸溶时,生成氯化铝、氯化铁和氯化亚铁的混合溶液,二氧化硅不溶于酸,则滤渣1为二氧化硅;过氧化氢能与亚铁离子反应生成铁离子,向溶液中加入适量NaOH溶液发生反应生成聚合碱式氯化铝铁。
(1)配料中的氧化铝为两性氧化物;步骤Ⅱ酸溶时,氧化铝与盐酸反应生成氯化铝和水,离子方程式为Al2O3+ 6H+=2Al 3++3H2O;
(2)分析可知,滤渣1为二氧化硅;
(3)酸溶时溶液中含有亚铁离子,加入H2O2溶液可使亚铁离子变为铁离子,反应的离子方程式为2Fe2++ H2O2+2H+= 2Fe3++2H2O;
(4)若加入过量的NaOH时,无机高分子絮凝剂聚合碱式氯化铝铁中的Al元素变为偏铝酸钠,铁元素变为氢氧化铁沉淀;步骤Ⅵ中,可经过过滤、洗涤、干燥可得到无机高分子絮凝剂聚合碱式氯化铝铁;
(5) 步骤1中得到的固体为氧化铁和氧化铝的混合物;步骤2中得到的固体为氧化铁,质量为0.8000g,其物质的量为0.005mol;则氧化铝的质量为3.3500-0.80000=2.5500g,物质的量为0.025mol,则n(Fe):n(Al)=0.005:0.025=1:5。

 阅读快车系列答案
阅读快车系列答案【题目】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol
C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol
2C(s)+O2(g)=2CO(g)△H3=-221kJ/mol
若某反应的平衡常数表达式为:K=[c(N2) ·c2(CO2)]/[c2(NO) ·c2(CO)],则此反应的热化学方程式为____________________________________。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
t/min | 0 | 1 | 2 | 3 | 4 | 5 |
c(N2O5)/<mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为p0,第2min时体系压强为p1,则p1∶p0=__________。2~5min内用NO2表示的该反应的平均反应速率为__________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是__________。(填字母)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)![]() NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用k正、k逆表示)。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用k正、k逆表示)。
(4)如图是密闭反应器中按n(N2) ∶n(H2)=1∶3投料后,在200℃、400℃、600℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。

①曲线a对应的温度是__________。
②M点对应的H2的转化率是__________。
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:______________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8。)