题目内容
【题目】(1)在一定条件下氨气和氧气能发生反应生成氮气和水蒸气:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H
查阅资料可得有关的化学键键能数据如下:
化学键 | N≡N | H-O | N-H | O=O |
E/ (kJ·mol-1) | 946 | 463 | 391 | 496 |
由此计算上述反应的反应热△H=___________kJ·mol-1。
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为___________(用K1、K2、K3表示)。
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为___________,O2的转化率为___________(用百分数表示,且保留小数点后一位),该反应的平衡常数为___________(列出计算式即可)。
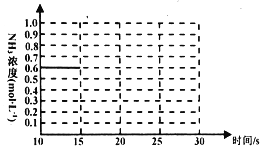
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。__________
(3)下列有关该反应的说法正确的是___________(填字母)。
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:_______________________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8)
【答案】-1268 K=k12﹒k33/k22 0.04mol﹒L-1﹒s-1 38.5% ![]()
 C 碱性,NH4+的水解常数为:Kh(NH4+)=Kw/Kb= 1.0×10-14/1.8×10-5 ,SO32-的水解常数为:Kh(SO32-)=Kw/Ka2= 1.0×10-14/6.3×10-8 ,∵NH4+的水解程度小于SO32-的水解程度,∴(NH4)2SO3显碱性
C 碱性,NH4+的水解常数为:Kh(NH4+)=Kw/Kb= 1.0×10-14/1.8×10-5 ,SO32-的水解常数为:Kh(SO32-)=Kw/Ka2= 1.0×10-14/6.3×10-8 ,∵NH4+的水解程度小于SO32-的水解程度,∴(NH4)2SO3显碱性
【解析】
(1)反应焓变△H=反应物总键能-生成物总键能;
(2)已知:a、N2(g)+O2(g)=2NO(g) K1
b、N2(g)+3H2(g)=2NH3(g) K2
c、2H2(g)+O2(g)=2H2O(g) K3
①上述2a+3b-2c得氨催化氧化反应;
②根据反应速率v=△c/△t计算、根据化学平衡的三段式计算、根据平衡常数的表达式计算;
③温度不变,平衡常数不变,算出平衡时氨的浓度。
(3)A.恒温恒容,再充入4molNH3和5.2molO2,相当于加压,平衡逆向移动,再次达到平衡时,NH3的转化率减小;
B.恒温恒容,容器中气体的质量不变,当容器内的密度保持不变时,无法判断反应是否达到了平衡;
C.反应前后气体的物质的量改变,当混合气体的平均摩尔质量不变时,反应达到了平衡;
D.当3v正(NO)=2v逆(H2O)时,反应达到了平衡.
(4)根据铵根离子和亚硫酸根离子的水解程度来判断。
(1)4NH3(g)+3O2(g)=2N2(g)+6H2O(g),反应的△H=产物的生成热之和-反应物的生成热之和=(2×946+12×463-12×391-3×496)KJ·mol-1=-1268KJ·mol-1;
(2)已知:a、N2(g)+O2(g)=2NO(g) K1
b、N2(g)+3H2(g)=2NH3(g) K2
c、2H2(g)+O2(g)=2H2O(g) K3
①上述2a+3b-2c得氨催化氧化反应,平衡常数K为K=k12﹒k33/k22 ;
② 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
起始量 4mol 5.2mol 0 0
变化量 1.6mol 2.0mol 1.6mol 2.4mol
平衡量 2.4mol 3.2mol 1.6mol 2.4mol
c平/mol﹒L-1 0.6 0.8 0.4 0.6
NH3的速率为1.6mol /(4L·10s)=0.04mol﹒L-1﹒s-1;
O2的转化率为2.0mol/5.2mol ×100%=38.5%;
该反应的平衡常数为K= ![]() 。
。
③ 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
c平/mol﹒L-1 0.5 0.65 0 0
c平/mol﹒L-1 4x 5x 4x 6x
c平/mol﹒L-1 0.5-4x 0.65-5x 4x 6x
用在温度不变时平衡常数不变,列方程求解,高次方程,中学不作要求,故作平衡图象时,氨的浓度在0~0.3mol﹒L-1 即可, 。
。
(3)A.恒温恒容,再充入4molNH3和5.2molO2,相当于加压,平衡逆向移动,再次达到平衡时,NH3的转化率减小,故A错误;
B.恒温恒容,容器中气体的质量不变,当容器内的密度保持不变时,无法判断反应是否达到了平衡,故B错误;
C.反应前后气体的物质的量改变,当混合气体的平均摩尔质量不变时,反应达到了平衡,故C正确;
D.当3v正(NO)=2v逆(H2O)时,反应达到了平衡,故D错误。
故选C。
(4)常温下(NH4)2SO3溶液碱性。NH4+的水解常数为Kh(NH4+)=Kw/Kb = 1.0×10-14/1.8×10-5 ,SO32-的水解常数为Kh(SO32-)=Kw/Ka2= 1.0×10-14/6.3×10-8 。∵NH4+的水解程度小于SO32-的水解程度,∴(NH4)2SO3显碱性。

 阅读快车系列答案
阅读快车系列答案【题目】在进行化学实验时,经常会有与预期不符的现象出现。某化学实验小组在实验室进行铁盐与亚铁盐相互转化的实验,就出现了与预设不太一致的现象。
实验I:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________。
(2)该小组同学用对比实验法探究白色沉淀产生的原因,请将其方案补充完整:
实验方案 | 现象 | 结论 |
步骤1:取4mL_________mol/ L CuSO4溶液,向其中滴加3滴0.1mo/ L KSCN溶液 | 产生白色沉淀 | Cu SO4与KSCN反应产生了白色沉淀 |
步骤2:取4mL0.2mol/ L FeSO4溶液,向其中滴加3滴0.1mol/ L KSCN溶液 | ___________ |
查阅资料:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
③(SCN)2的化学性质与I2相似
则Cu2+与SCN-反应的离子方程式为____________________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/L FeSO4溶液中加入lmL8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色) ②Fe(NO)2+与HNO3不反应
Fe(NO)2+(棕色) ②Fe(NO)2+与HNO3不反应
(3)用离子方程式解释NO产生的原因____________________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应I:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应I的速率比反应Ⅱ___________(填“快”或“慢”)。
②乙认为反应I是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是_______________________________________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因______________________。
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,他利用实验室常用的仪器和药品设计并完成了如图所示的实验,实现了Fe2+![]() Fe3+的转化,同时避免出现此异常现象。实验发现:U形管右侧有气泡,U形管左侧的现象为___________、B溶液是___________溶液(填化学式)。
Fe3+的转化,同时避免出现此异常现象。实验发现:U形管右侧有气泡,U形管左侧的现象为___________、B溶液是___________溶液(填化学式)。