��Ŀ����
����Ŀ��ij��ҵ��������Ҫ����Al2O3��Co2O3CoO������Fe3O4�Ƚ��������Co2O3CoO����ǿ�Ӧ����ʵ���ҿƼ���Ա����֮���벢�Ʊ�������ʣ�����������£� 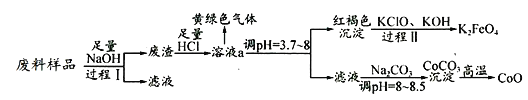
��1�����̢��еIJ���������__��д�����̢�����Ӧ�Ļ�ѧ����ʽ____________��
��2����Һa�к��н��������� _________________��
��3����Һa���ݳ��Ļ���ɫ����������������˵������ȷ����_________��
����������Ư���Ե���������
��Һ�Ⱥ���ˮ��ΪҺ�壬�Ҷ������ȷ���
�۽�����ͨ���Һʱ���������������������ǻ�ԭ��
�ܴ���������ֽ⣬˵��������������
������ˮ�е���������Һ���а�ɫ�������ɣ�˵����ˮ�к�Cl��
��4��д�����̢�����Ӧ�����ӷ���ʽ��_______________________________��
������ص��ܷ�ӦΪ��3Zn+2K2FeO4+8H2O![]() 3Zn��OH��2+2Fe��OH��3+4KOH
3Zn��OH��2+2Fe��OH��3+4KOH
����ʱ������ӦʽΪ___________________________________��
��5��Co�����γ�CoC2O42H2O��MΪ183g/mol����5.49g�þ����ڿ����м��ȣ��ڲ�ͬ�¶��·ֱ�õ�һ�ֹ������ʣ������������
�¶ȷ�Χ���棩 | ����������g�� |
150��210 | 4.41 |
290��320 | 2.41 |
890��920 | 2.25 |
���ⶨ��210�桫290������У�����������ֻ��CO2����˹��̷����Ļ�ѧ��Ӧ����ʽΪ��______________________________________��
���𰸡� ���� Al2O3+2NaOH�T2NaAlO2+H2O Co2+��Fe3+ ������ 2Fe��OH��3+3ClO��+4OH���T2FeO42��+5H2O+3Cl�� Fe��OH��3��3e��+5OH���TFeO42��+4H2O 3CoC2O4+2O2![]() Co3O4+6CO2
Co3O4+6CO2
����������������������Ժ���Al2O3��Co2O3CoO������Fe3O4�Ƚ���������Ĺ�ҵ����Ϊԭ�Ͻ������ʵķ�����Ʊ�Ϊ���壬���鹤ҵ���̵ķ�����Cl2�����ʡ����ε�ص缫��Ӧʽ����д�����ط����ļ��㡣������Ʒ�м���������NaOH��Һ������Al2O3������Ӧ���ܽ⣬Co2O3CoO��Fe3O4���ܣ�����IΪ���˲������õ�����������Ҫ��Co2O3CoO��Fe3O4�������м�������HCl��������֪��Co2O3CoO��HCl��Ӧ����CoCl2��Cl2������ɫ����������Ӧ�ķ���ʽΪCo2O3CoO+8HCl=3CoCl2+Cl2��+4H2O��ͨ���˷�Ӧ˵��Co2O3CoO����ǿ�����ԣ������Ա�Cl2ǿ�����ڴ˹�����Fe3O4Ҳ������Ӧת����FeCl3����Һa�е�����ΪCoCl2��FeCl3��HCl������Һa��pH����3.7~8�������ɫ������FeCl3ת����Fe��OH��3�����������������ʱ�õ�����Һ����Ҫ�ɷ�ΪCoCl2������II��Fe��OH��3��KClO��KOH��Ӧ�Ʊ�K2FeO4���˷�Ӧ��Fe��OH��3��������FeO42-��ClO-����ԭ��Cl-����Ӧ�Ļ�ѧ����ʽΪ3KClO+2Fe��OH��3+4KOH=2K2FeO4+3KCl+5H2O����Һ�м���Na2CO3����CoCO3������CoCO3�ڸ����·ֽ����CoO��
��1������I�IJ����ǹ��ˡ�����I��Al2O3��NaOH��Ӧ�ķ���ʽΪAl2O3+2NaOH�T2NaAlO2+H2O��
��2������������������Һa�еĽ���������Co2+��Fe3+��
��3����Cl2û��Ư���ԣ�������Һ��Ϊ�����ֻ��������������ˮΪ�������к�Cl2��H2O��HClO��H+��Cl-��ClO-������OH-����ȷ����������ͨ���Һʱ��������Ӧ��Cl2+2OH-=Cl-+ClO-+H2O�������������������ǻ�ԭ������ȷ���ܴ���������ֽ⣬˵����������в��ȶ��������������ԣ���������ˮ�е���������Һ���а�ɫ�������ɣ�˵����ˮ�к�Cl������ȷ����ѡ��������
��4������II��Ӧ�Ļ�ѧ����ʽΪ3KClO+2Fe��OH��3+4KOH=2K2FeO4+3KCl+5H2O�����ӷ���ʽΪ2Fe��OH��3+3ClO��+4OH���T2FeO42��+5H2O+3Cl�������ʱ�ķ�Ӧ����ʽΪ3Zn��OH��2+2Fe��OH��3+4KOH =3Zn+2K2FeO4+8H2O�����ʱ��������ʧ���ӵ�������Ӧ������ʱ������ӦʽΪFe��OH��3��3e��+5OH���TFeO42��+4H2O��
��5��n��CoC2O42H2O��=5.49g![]() 183g/mol=0.03mol�����к��нᾧˮ������Ϊ0.06mol
183g/mol=0.03mol�����к��нᾧˮ������Ϊ0.06mol![]() 18g/mol=1.08g��210��ʱ���������Ϊ4.41g��������������5.49g-4.41g=1.08g����210��ʱ����ΪCoC2O4��210�桫290������в���������ֻ��CO2����290�����ΪCo�������290��ʱ���������Ϊ2.41g������Co�غ㣬����n��Co��=0.03mol��m��Co��=0.03mol
18g/mol=1.08g��210��ʱ���������Ϊ4.41g��������������5.49g-4.41g=1.08g����210��ʱ����ΪCoC2O4��210�桫290������в���������ֻ��CO2����290�����ΪCo�������290��ʱ���������Ϊ2.41g������Co�غ㣬����n��Co��=0.03mol��m��Co��=0.03mol![]() 59g/mol=1.77g��n��O��=
59g/mol=1.77g��n��O��=![]() =0.04mol��n��Co����n��O��=3:4����290��ʱ����ΪCo3O4��210����290�淴Ӧ������Co�Ļ��ϼ����ߣ�������O2���뷴Ӧ����210����290������з�Ӧ�Ļ�ѧ����ʽΪ3CoC2O4+2O2
=0.04mol��n��Co����n��O��=3:4����290��ʱ����ΪCo3O4��210����290�淴Ӧ������Co�Ļ��ϼ����ߣ�������O2���뷴Ӧ����210����290������з�Ӧ�Ļ�ѧ����ʽΪ3CoC2O4+2O2![]() Co3O4+6CO2��
Co3O4+6CO2��

 ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�����Ŀ��MnSO4�ڹ�ҵ������ҪӦ�ã������̿�(��Ҫ�ɷ�ΪMnO2��ˮ������Fe2O3��FeO��Al2O3������PbO������)�����Ʊ�MnSO4����������£�


�����ϡ������������γ��������������pH
���� | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
��ʼ����ʱ��pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
��ȫ����ʱ��pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
(1)�����̿���ͨ��SO2����MnSO4���÷�Ӧ�Ļ�ѧ������___________��
(2)����MnO2����ҪĿ����___________��
(3)���������Һ���м���ʯ�ҽ������ڵ���pH��pHӦ����____��Χ�����ɵij�����Ҫ����____������CaSO4��
(4) ��������������������Ҫ��ȥ��������______________��
(5) �ö��Ե缫���MnSO4��Һ�������Ƶø���MnO2�����MnSO4��ZnSO4��H2SO4�Ļ����Һ���Ʊ�MnO2��Zn��д�������ĵ缫��Ӧ����ʽ________________��
����Ŀ��T��ʱ�����ݻ���Ϊ0.5L�������ܱ������з�����2A��g��+B��g��2C��g����H=��Q kJ/mol (Q>0)��6min���������з�Ӧ��ƽ�⣬�й��������±���������������ȷ����
������� | ��ʼʱ���������ʵ���/mol | ��ƽ��ʱ��ϵ�����ı仯 | ||
A | B | C | ||
�� | 2 | 1 | 0 | 0.75QkJ |
�� | 0.4 | 0.2 | 1.6 | |
A. 0-6min,v(A)=0.25mol/(L��min)
B. ���д�ƽ��ʱ�ų�������Ϊ0.05QkJ
C. �����������䣬�������ڱ��־��Ⱥ��ݣ���ﵽƽ��ʱC���������С��2/3
D. ���ٴ�ƽ�����ͨ��1molA��0.5molB���ٴ�ƽ��ʱA��ת��������

