题目内容
【题目】下列溶液一定显酸性的是( )
A. 含H+的溶液 B. c(OH-)<c(H+)的溶液
C. pH<7的溶液 D. 能与金属Al反应放出H2的溶液
【答案】B
【解析】试题分析:A.任何溶液中都含有氢离子,所以含有氢离子的溶液不一定呈酸性,故A错误;B.c(OH-)<c(H+),则溶液呈酸性,故B正确;C.pH<7的溶液不一定是酸性溶液,如100℃时,纯水的pH=6,则6<pH<7的溶液呈碱性,故C错误;D.酸能和铝反应生成氢气,强碱溶液也能与铝反应生成氢气,所以能与铝反应放出氢气的溶液不一定是酸溶液,故D错误;故选B。

 阅读快车系列答案
阅读快车系列答案【题目】在恒温、恒容的密闭容器中,混合气体A、B、C 的物质的量浓度(c)与时间(t) 的关系如下表所示:
t c | 初始 | 2min | 4min | 6min | 8min |
c(A)( mol·L -1) | 2.50 | 2.20 | 2.00 | 2.00 | 2.20 |
c(B)( mol·L -1) | 1.56 | 2.16 | 2.56 | 2.56 | 2.16 |
c(C)( mol·L -1) | 0.39 | 0.54 | 0.64 | 0.64 | 1.54 |
请填空:
(1)前2 min内,v(B)= _______________________。
(2) 到2 min末A 的转化率为_________________。
(3)该反应的化学方程式为_______________________________________。
(4)6 min - 8 min若只改变了反应体系中某一种物质的浓度,则应为_____(填选项字母)
a.增大A的浓度 b.减小B的浓度 c.增大C的浓度
则该物质的浓度改变量为________________mol·L -1
(5)如果在相同条件下,若开始加入的三种物质的物质的量浓度是原来的2倍,则_____是原来的2倍。
a. B的平衡浓度 b. 达到平衡的时间 c. 平衡时气体的密度 d. 平衡常数
【题目】某工业废料中主要含有Al2O3、Co2O3CoO、少量Fe3O4等金属氧化物(Co2O3CoO不与强碱反应).实验室科技人员欲将之分离并制备相关物质,设计流程如下: 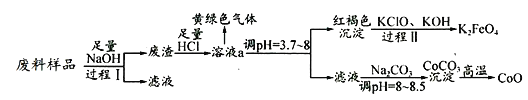
(1)过程Ⅰ中的操作名称是__,写出过程Ⅰ发生反应的化学方程式____________.
(2)溶液a中含有金属离子有 _________________.
(3)溶液a中逸出的黄绿色气体是氯气,下列说法不正确的是_________.
①氯气是有漂白性的酸性气体
②液氯和氯水均为液体,且都含有氯分子
③将氯气通入碱液时,氯气既是氧化剂,又是还原剂
④次氯酸见光易分解,说明次氯酸是弱酸
⑤向氯水中滴硝酸银溶液,有白色沉淀生成,说明氯水中含Cl-
(4)写出过程Ⅱ发生反应的离子方程式:_______________________________.
高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
则充电时阳极反应式为___________________________________.
(5)Co可以形成CoC2O42H2O(M为183g/mol),5.49g该晶体在空气中加热,在不同温度下分别得到一种固体物质,其质量如表:
温度范围(℃) | 固体质量(g) |
150﹣210 | 4.41 |
290﹣320 | 2.41 |
890﹣920 | 2.25 |
经测定,210℃~290℃过程中,产生的气体只有CO2,则此过程发生的化学反应方程式为:______________________________________.


