题目内容
【题目】某兴趣小组欲制备漂白剂亚氯酸钠(NaClO2)。甲同学通过查阅文献发现:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
实验I 乙同学利用下图所示装置制取NaClO2晶体

(l)装置B中盛装浓硫酸的仪器名称是______,装置A和E的作用是__________。
(2)装置D中发生反应的化学方程式为_____________________________________。
(3)反应结束后,先将装置D反应后的溶液在55℃条件下减压蒸发结晶,然后进行的操作是_______,再用38℃~60℃的温水洗涤,最后在低于60℃条件下干燥,得到NaClO2晶体。
实验Ⅱ 丙同学设计实验测定制得NaClO2样品的纯度
其实验步骤如下:
① 称取所得亚氯酸钠样品ag于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应后,配成100mL混合液。
② 取25.00 mL待测液于锥形瓶中,用bmol/LNa2S2O3标准液滴定,消耗标准液体积的平均值为VmL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)步骤① 反应的离子方程式为____________________________________。
(5)步骤② 滴定中使用的指示剂是____________________。
(6)样品中NaClO2的质最分数为______________(用含a、b、V的代数式表示)。
【答案】 分液漏斗 吸收ClO2,防止污染空气 2NaOH +2ClO2+ H2O2=2NaClO2+2H2O+O2↑ 趁热过滤 ClO2-+4I-+4H+=2H2O+2I2+Cl- 淀粉溶液 ![]()
【解析】试题分析:本题考查NaClO2晶体的制备,物质纯度的测定和滴定实验。
(1)装置B中盛浓H2SO4的仪器为分液漏斗。装置B用于制备ClO2,装置B中反应的化学方程式为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O,装置A和E中的NaOH用于吸收ClO2,防止污染空气。
(2)装置D中ClO2与NaOH和H2O2的混合溶液反应制备NaClO2,ClO2被还原成NaClO2,则H2O2被氧化成O2,写出反应ClO2+NaOH+H2O2→NaClO2+O2↑+H2O,用化合价升降相等和原子守恒可配平得化学方程式为2NaOH +2ClO2+ H2O2=2NaClO2+2H2O+O2↑。
(3)由于NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,所以反应结束后,先将装置D反应后的溶液在55℃条件下减压蒸发结晶(温度控制55℃的目的是防止温度高于60℃NaClO2分解成NaClO3和NaCl),然后进行的操作是趁热过滤(防止温度低于38℃时析出NaClO2·3H2O)。
(4)根据实验步骤分析,步骤①为NaClO2在酸性条件下将KI氧化成I2,自身还原成Cl-,反应为ClO2-+I-+H+→Cl-+I2+H2O,用化合价升降相等可得ClO2-+4I-+H+→Cl-+2I2+H2O,结合原子守恒和电荷守恒,写出离子方程式为ClO2-+4I-+4H+=2I2+Cl-+2H2O。
(5)由于用Na2S2O3滴定I2,I2遇淀粉呈特征的蓝色,所以选用淀粉溶液作指示剂,实验终点的实验现象为:滴入一滴Na2S2O3溶液,溶液由蓝色褪为无色且在30s内不恢复。
(6)根据反应写出关系式:NaClO2~2I2~4Na2S2O3,n(NaClO2)=n(Na2S2O3)/4=bV![]() 10-3/4mol,原样品中NaClO2物质的量为bV
10-3/4mol,原样品中NaClO2物质的量为bV![]() 10-3/4mol
10-3/4mol![]() = bV
= bV![]() 10-3mol,质量为90.5bV
10-3mol,质量为90.5bV![]() 10-3g,样品中NaClO2的质量分数为
10-3g,样品中NaClO2的质量分数为![]() =
=![]() 。
。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】某工业废料中主要含有Al2O3、Co2O3CoO、少量Fe3O4等金属氧化物(Co2O3CoO不与强碱反应).实验室科技人员欲将之分离并制备相关物质,设计流程如下: 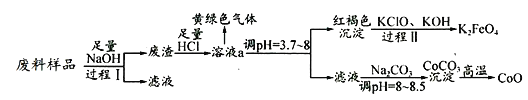
(1)过程Ⅰ中的操作名称是__,写出过程Ⅰ发生反应的化学方程式____________.
(2)溶液a中含有金属离子有 _________________.
(3)溶液a中逸出的黄绿色气体是氯气,下列说法不正确的是_________.
①氯气是有漂白性的酸性气体
②液氯和氯水均为液体,且都含有氯分子
③将氯气通入碱液时,氯气既是氧化剂,又是还原剂
④次氯酸见光易分解,说明次氯酸是弱酸
⑤向氯水中滴硝酸银溶液,有白色沉淀生成,说明氯水中含Cl-
(4)写出过程Ⅱ发生反应的离子方程式:_______________________________.
高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
则充电时阳极反应式为___________________________________.
(5)Co可以形成CoC2O42H2O(M为183g/mol),5.49g该晶体在空气中加热,在不同温度下分别得到一种固体物质,其质量如表:
温度范围(℃) | 固体质量(g) |
150﹣210 | 4.41 |
290﹣320 | 2.41 |
890﹣920 | 2.25 |
经测定,210℃~290℃过程中,产生的气体只有CO2,则此过程发生的化学反应方程式为:______________________________________.
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实 | 用CCl4提取 | 除去乙醇中的苯酚 | 从KI和I2的固体 | 配制100mL 0.1000 |
装 |
|
|
|
|
A.A
B.B
C.C
D.D






