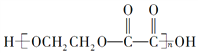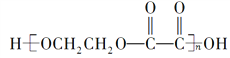题目内容
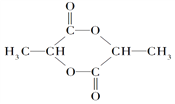
【题目】下面是某化学活动小组在研究性学习中探索葡萄糖分子的组成和结构时设计并完成的一组实验:将下列四种液体分别取2 mL先后加到2 mL的新制Cu(OH)2中,充分振荡。实验现象记录如表:

根据上述实验及现象能够得出的正确结论是( )
A. 葡萄糖分子中可能含有醛基
B. 葡萄糖分子中可能含有多个羟基
C. 葡萄糖的分子式为C6H12O6
D. 葡萄糖分子碳链呈锯齿形
【答案】B
【解析】葡萄糖溶液中含有葡萄糖分子和水分子,水加入到新制Cu(OH)2中,氢氧化铜不溶,混合物蓝色变浅,证明水与氢氧化铜不反应;乙醇加入到新制Cu(OH)2中,氢氧化铜不溶,混合物蓝色变浅,证明乙醇与氢氧化铜不反应;丙三醇加入到新制Cu(OH)2中,氢氧化铜溶解,溶液呈绛蓝色,证明丙三醇与氢氧化铜反应;葡萄糖溶液加入到新制Cu(OH)2中,氢氧化铜溶解,溶液呈绛蓝色,证明葡萄糖与氢氧化铜反应;乙醇含有一个羟基,不反应,丙三醇含有三个羟基,能反应,葡萄糖能反应,证明应该是含有多个羟基的原因,能够得出的结论应该是葡萄糖分子中可能含有多个羟基。而其他结论虽然正确,但没有在本题中得到证明。答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】利用废碱渣(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,可制得无水Na2SO3(成品),其流程如图所示。
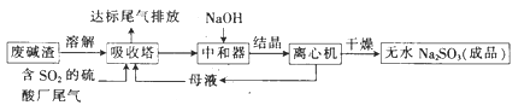
(1)某硫酸厂排放出的尾气中SO2的含量特别髙,而废碱渣的量不足,此时“吸收塔”内发生反应的离子方程式为_______________(不考虑H2O与SO2反应)。
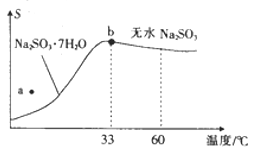
(2)亚硫酸钠的溶解度曲线如图所示,则上述流程中“结晶”的方法是___________(填“蒸发结晶”或“降温结晶”),图中a点所示分散系类别为____________(填“浊液”“胶体”或“溶液”)。
(3)仅用BaCl2、H2O2和过量稀盐酸的混合溶液难以检出“成品”中的SO32-,原因是“成品”中含有某种杂质阴离子。
①该杂质阴离子为________________(填离子符号)。
②25℃时,部分钡盐的Ksp如下表所示。
化学式 | BaSO4 | BaSO3 |
Ksp | 1.1×10-10 | 5.5×10-7 |
将得到的“成品”溶于水,测得溶液中SO32-的浓度为0.5mol L-1,为杂质阴离子浓度的10倍,向该溶液中加入等体积、0.5mol·L-1的BaCl2溶液,充分反应后c(Ba2+)=_______mol L-1。(混合时溶液体积的变化忽略不计)
(4)某同学采用如下方法检验SO32-:
![]()
①洗涤时使用的试剂最好为____________(填字母)。
a.稀HNO3 b.蒸馏水 c.稀H2SO4
②根据上述流程中的数据(w、x、y)_____________ (填“能”或“不能”)计算出成品试样中SO32-的百分含量,若能,则SO32-的百分含量为 (若不能,则此空不填);若不能,则理由是_____________(若能,则此空不填)。