题目内容
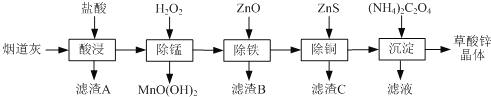
【题目】以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O42H2O)
已知:常温下Ksp[Fe(OH)3]=2.6×10-39, Ksp[Cu(OH)2]=2.2×10-20。
请问答下列问题:
(1)为了提高“酸浸”时锌元素的浸出率,可以采取的措施有:_________、________(填写2条)。
(2)“除锰”反应后,溶液的pH__________(填“增大”“减小”或“不变”)。
(3)常温下“除铁”反应中,加入ZnCO3可调节溶液的pH,使得Fe3+和部分Cu2+被除去,当两种沉淀共存且溶液的pH=8时,c(Cu2+)/ c( Fe3+)=________________ 。
(4)“除铜”反应的离子方程式为________。
(5)若“沉淀”过程中采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,应该在搅拌下,将Na2C2O4溶液缓慢加入ZnCl2溶液中,如果顺序颠倒,会产生的不良后果是__________。
(6)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率(剩余固体的质量/原始固体的质量×100%)随温度的变化如图所示,则A、B点固体的化学式分别为____、___________。
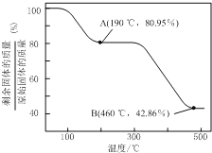
【答案】适当提高盐酸浓度 适当提高反应温度、适当加快搅拌速率、适当延长酸浸时间(填2条即可) 减小 8.5×1012 ZnS+Cu2+![]() CuS+Zn2+ 产生Zn (OH)2杂质 ZnC2O4 ZnO
CuS+Zn2+ 产生Zn (OH)2杂质 ZnC2O4 ZnO
【解析】
用含主要成分为ZnO,还含有少量Fe2O3,CuO,SiO2和MnO的原料制备草酸锌晶体,所以制备过程中应当想办法除去Fe,Cu,Si,Mn等杂质元素;第一步对原料进行酸浸操作,除SiO2不溶于盐酸外,其余的组分都溶解成相应的金属阳离子,这一步就将SiO2杂质去除了;接着,向酸浸后的滤液中加入过氧化氢,进行除锰操作,原料中的Mn为+2价,除锰操作获得的是+4价的锰,所以这一步骤中,Mn被氧化;接着,除铁步骤利用ZnO调节溶液pH值,将Fe3+除去;除铜步骤,加入的是ZnS,生成CuS,这一步涉及沉淀的转化反应;最后向溶液中加入草酸铵最终获得草酸锌产品。
(1)为了提高浸出率,可以想办法提高酸浸时的反应速率,或者延长酸浸时间;因此可以提高酸浓度,或者提高温度,或者充分搅拌等;
(2)除锰步骤中,过氧化氢与溶液中的Mn2+发生氧化还原反应,离子方程式为:![]() ;由于生成了H+,所以溶液的pH减小;
;由于生成了H+,所以溶液的pH减小;
(3)Fe(OH)3和Cu(OH)2两种沉淀共存时,有:![]() 以及
以及![]() 成立;所以:
成立;所以: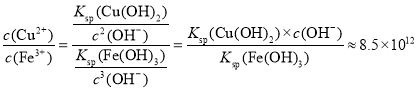 ;
;
(4)除铜时加入的是ZnS,生成的是CuS,发生的反应离子方程式为:![]() ;
;
(5)由于草酸钠的碱性相比于草酸铵更强,所以若将ZnCl2溶液直接加入草酸钠溶液中,可能会生成Zn(OH)2杂质;
(6)假设加热的草酸锌晶体的初始质量为189g,即1mol;那么根据图像可知,A点时,固体质量剩余约为153g,失去的质量恰好是草酸锌晶体中结晶水的质量,所以A点固体的化学式为ZnC2O4;B点时,固体剩余质量约为81g,B点后质量几乎不再变化,根据质量守恒关系,B点的固体中除65g锌元素,剩余的即为16gO元素,所以B点固体的化学式为ZnO。

 阅读快车系列答案
阅读快车系列答案【题目】碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5mol·L-1 MgSO4溶液和0.5mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500mL NH4HCO3溶液于1000mL三颈烧瓶中,开启搅拌器。温度控制在50℃。
步骤3:将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,1min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1h后,过滤,洗涤。
步骤5:在40℃的真空干燥箱中干燥10h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
①步骤2控制温度在50℃,较好的加热方法是_________。
②步骤3生成MgCO3·nH2O沉淀的化学方程式为__________。
③步骤4检验沉淀是否洗涤干净的方法是__________。
(2)测定生成的MgCO3·nH2O中的n值。
称量1.000碳酸镁晶须,放入如图所示的广口瓶中加入适量水,并滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后将烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
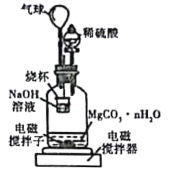
①图中气球的作用是_________。
②上述反应后期要升温到30℃,主要目的是______。
③测得每7.8000g碳酸镁晶须产生标准状况下CO2为1.12L,则n值为_______。
(3)碳酸镁晶须可由菱镁矿获得,为测定某菱镁矿(主要成分是碳酸镁,含少量碳酸亚铁、二氧化硅)中铁的含量,在实验室分别称取12.5g菱镁矿样品溶于过量的稀硫酸并完全转移到锥形瓶中,加入指示剂,用0.010mol/L H2O2溶液进行滴定。平行测定四组。消耗H2O2溶液的体积数据如表所示。
实验编号 | 1 | 2 | 3 | 4 |
消耗H2O2溶液体积/mL | 15.00 | 15.02 | 15.62 | 14.98 |
①H2O2溶液应装在_________(填“酸式”或“碱式”)滴定管中。
②根据表中数据,可计算出菱镁矿中铁元素的质量分数为_________ %(保留小数点后两位)。
【题目】下列由实验操作得到的实验现象或结论不正确的是
实验操作 | 实验现象或结论 | |
A | 向某溶液中加入稀硫酸,生成淡黄色沉淀和有刺激性气味的气体 | 该溶液中一定含有S2O32- |
B | 向3ml KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色 | 氧化性:Br2>I2 |
C | 相同条件下,测定等浓度的Na2CO3溶液和Na2SO4溶液的pH,前者呈碱性,后者呈中性 | 非金属性:S>C |
D | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
A.AB.BC.CD.D