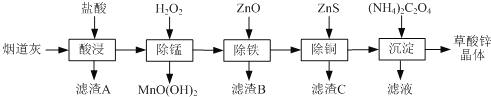
题目内容
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是________,基态D原子价电子的轨道表达式为________________。
(2)DA2分子的VSEPR模型是____________。
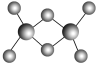
(3)实验测得C与氯元素形成的化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于________(填晶体类型)晶体,其中C原子的杂化轨道类型为________杂化。
②[C(OH)4]-中存在的化学键有____________________________________________。
(4)单质A有两种同素异形体,其中沸点高的是__________ (填分子式),原因是______________________________________________________________
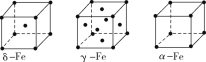
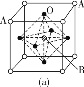
(5)D与E所形成化合物晶体的晶胞如图所示 。
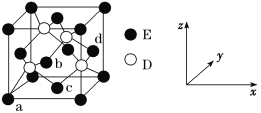
①在该晶胞中,E的配位数为________。
②原子坐标参数可表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数a为(0,0,0);b为(1/2,0,1/2);c为(1/2,1/2,0)。则d的坐标参数为________。
【答案】镁(或Mg) ![]() 平面三角形 分子 sp3 极性共价键、配位键(或共价键、配位键) O3 O3的相对分子质量大,分子间作用力也大,沸点也高 4 (1,1/2,1/2)
平面三角形 分子 sp3 极性共价键、配位键(或共价键、配位键) O3 O3的相对分子质量大,分子间作用力也大,沸点也高 4 (1,1/2,1/2)
【解析】
A、D为同主族且有两种常见化合物DA2和DA3,则A是O,D是S;工业上常电解熔融的C2O3来制取C,故C为Al;B在A、D之间且最外层只有两个电子,故B是Mg;由E位于元素周期表中ds区,E的最外层有两个电子且其余各层全充满,原子序数大于S,位于第四周期,则E是Zn。
综上,A、B、C、D、E分别为O、Mg、Al、S、Zn。
(1)Mg的最外层电子排布为3s2,而Al为3s23p1,Mg的3s能级全充满,较稳定,故Mg的第一电离能大于Al;D为S,其价电子排布式为3s23p4,结合泡利原理和洪特规则,可写出硫原子价电子轨道表达式为![]() ,
,
故答案为:镁(或Mg);![]() ;
;
(2)DA2为SO2,中心原子硫的价层电子对数为![]() =3,则其VSEPR模型为平面三角形,故答案为:平面三角形;
=3,则其VSEPR模型为平面三角形,故答案为:平面三角形;
(3)①C2Cl6为Al2Cl6,加热易升华可知其沸点较低,推测其为分子晶体;由球棍模型图可知铝原子的价层电子对数为4,则Al为sp3杂化;
②[Al(OH)4]-中,氢、氧原子之间形成O-H极性共价键,三个O与Al的三个电子形成Al-O极性共价键,此外,一个OH-中氧原子提供孤对电子,Al提供空轨道,形成O→Al配位键,
故答案为:分子;sp3;极性共价键、配位键;
(4)氧元素有O2和O3两种单质,其中O3的相对分子质量大,分子间作用力也大,沸点也高,
故答案为:O3;O3的相对分子质量大,分子间作用力也大,沸点也高;
(5)①在该晶胞中,与E相距最近的D原子个数为4,则E的配位数为4;
②该坐标系是以a为坐标原点的坐标系,根据b、c的坐标可得d原子的坐标为(1,![]() ,
,![]() );
);
故答案为:4;(1,![]() ,
,![]() )。
)。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】抗爆剂的添加剂常用1,2-二溴乙烷。如图为实验室制备1,2-二溴乙烷的装置图, 图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
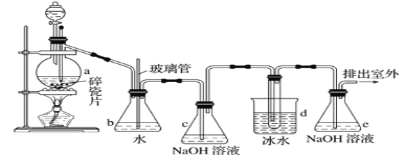
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,请写出发生堵塞时瓶b中的现象:①_____________________________;如果实验时d装罝中导管堵塞,你认为可能的原因是②___________________________________;
安全瓶b还可以起到的作用是③___________________________。
(2)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是_______________________。
(3)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正确情况下超过许多,如果装罝的气密性没有问题,试分析可能的原因:_____________________、_____________________________(写出两条即可)。
(4)除去产物中少量未反应的Br2后,还含有的主要杂质为________________,要进一步提纯,下列操作中必需的是
A.重结晶 B.过滤 C.萃取 D.蒸馏
(5)实验中也可以撤去d装置中盛冰水的烧杯,改为将冷水直接加入到d装置的试管中,则此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是___________。