题目内容
【题目】室温时,用0.0200mol/L稀盐酸滴定20.00mL0.0200mol/LNaY溶液,溶液中水的电离程度随所加稀盐酸的体积变化如图所示(忽略滴定过程中溶液的体积变化或密度变化),则下列有关说法正确的是()
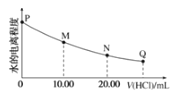
已知:K(HY)=5.0×10-11
A.M点溶液的pH>7
B.M点,c(Na+)=c(HY)+c(Y-)+c(Cl-)
C.可选取酚酞作为滴定指示剂
D.图中Q点水的电离程度最小,Kw<10-14
【答案】A
【解析】
根据题意,NaY是强碱弱酸盐,向其溶液中加盐酸,会发生强酸制弱酸的反应,生成HY;当加入的盐酸是NaY物质的量的一半时,即V(HCl)=10mL时,充分混合后,溶液可认为是等浓度的NaY和HY的混合溶液,当然溶质还有NaCl;当加入的盐酸与NaY物质的量相等时,即V(HCl)=20mL时,充分混合,溶液可认为是HY的溶液,当然溶质还有NaCl;若V(HCl)>20mL,那么溶液中的溶质组成为HY和NaCl以及HCl。
A.根据分析可知,M点的溶液可认为是等浓度的NaY和HY的混合溶液,又因为![]() ,那么室温下,
,那么室温下,![]() ,所以NaY的水解程度比HY的电离程度更大,溶液显碱性,A项正确;
,所以NaY的水解程度比HY的电离程度更大,溶液显碱性,A项正确;
B.无论加入的盐酸体积是多少,均有物料守恒关系式为:![]() ;M点加入的盐酸体积不为0,所以有:
;M点加入的盐酸体积不为0,所以有:![]() ,B项错误;
,B项错误;
C.当加入的盐酸与NaY物质的量相等时,达到滴定终点,此时溶液可认为是HY的溶液,当然溶质还有NaCl;所以终点时溶液显酸性,因此应当用甲基橙作指示剂,C项错误;
D.Q点时,V(HCl)>20mL,溶液中的溶质组成为HY和NaCl以及HCl,相比于图像中的其他点,水的电离程度最小,但是![]() 只与温度有关,所以室温下,仍为10-14,D项错误;
只与温度有关,所以室温下,仍为10-14,D项错误;
答案选A。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目