��Ŀ����
����Ŀ��ij��λ������Ϊ����ɫ���壬��ԭ��������С�����A��B��C��D��E����Ԫ����ɣ���ԭ�Ӹ�����Ϊ14��4��5��1��1������C��Dͬ������ԭ������DΪC��2����EԪ�ص���Χ�����Ų�ʽΪ(n��1)dn��6ns1���Իش��������⣺
��1��Ԫ��B��C��D�ĵ�һ�������ɴ�С����˳��Ϊ________(��Ԫ�ط��ű�ʾ)��
��2��DԪ�ػ�̬ԭ�ӵ����������Ų�ͼΪ________��
��3������λ������Ļ�ѧʽΪ________�����������ԭ�ӵ��ӻ���ʽΪ________��
��4��CԪ�ؿ���AԪ���γ����ֳ����Ļ������ԭ�Ӹ����ȷֱ�Ϊ1��1��1��2�����ֻ������������Ȼ��ܣ���������Ҫԭ��Ϊ_______________��
��5��AԪ����BԪ�ؿ��γɷ���ʽΪB2A2��ij������û�����ķ��Ӿ���ƽ��ṹ������ṹʽΪ________�������к���________���Ҽ���________���м���
���𰸡�N��O��S 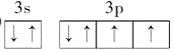 [Cu(NH3)4]SO4��H2O[��Cu(NH3)4SO4��H2O] sp3�ӻ� H2O2������H2O����֮���γ����(����������ԭ�������ӽṹ���Ƶ��������ܵȽǶȻش�ֻҪ�𰸺�������) H��N=N��H 3 1
[Cu(NH3)4]SO4��H2O[��Cu(NH3)4SO4��H2O] sp3�ӻ� H2O2������H2O����֮���γ����(����������ԭ�������ӽṹ���Ƶ��������ܵȽǶȻش�ֻҪ�𰸺�������) H��N=N��H 3 1
��������
ij��λ������Ϊ����ɫ���壬��ԭ��������С�����A��B��C��D��E����Ԫ����ɣ���ԭ�Ӹ�����Ϊ14��4��5��1��1��C��Dͬ������ԭ������DΪC��2����C����Ԫ�ء�D����Ԫ�أ�EԪ�ص���Χ�����Ų�ʽΪ(n��1)dn��6ns1����n+6=10����n=4������Χ�����Ų�Ϊ3d104sl����E��ͭԪ�أ��ʸ�����ɫ����Ӧ����[Cu(NH3)4]2+��SO42-�����ԭ��������֪AΪH��BΪN����ԭ����Ŀ֮�ȿ�֪��������ﺬ��1���ᾧˮ�����仯ѧʽΪ:[Cu(NH3)4]SO4![]() H2O��
H2O��
(1)������������֪��Ԫ��B��C��DԪ�طֱ���N��O��S��ͬ�������϶��µ�һ�����ܼ�С����OԪ�ص�һ�����ܴ���SԪ�أ�O��NԪ��ͬ���ڣ�NԪ��ԭ��2p�ܼ�����3�����ӣ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܴ���OԪ�أ��ʵ�һ�������ɴ�С������˳��Ϊ:N��O��S��(2)DΪSԪ�أ���ԭ�ӵ��������6�����ӣ������Ų�ͼΪ![]() ����3������λ������Ļ�ѧʽΪ[Cu(NH3)4]SO4
����3������λ������Ļ�ѧʽΪ[Cu(NH3)4]SO4![]() H2O��������NH3,����ԭ�ӵļ۵��Ӷ���=
H2O��������NH3,����ԭ�ӵļ۵��Ӷ���=![]() �����Ե�ԭ���ӻ���ʽΪΪsp3�ӻ�����4��OԪ�ؿ���HԪ���γɵ�ԭ�Ӹ����ȷֱ�Ϊ1��1��1��2�Ļ�����ֱ���H2O2��H2O��H2O2������H2O����֮���γ�������������ֻ������������Ȼ�������5��HԪ����NԪ�ؿ��γ�N2H2�����Ӿ���ƽ��ṹ��������ṹʽΪH��N=N��H������ȫ�ǦҼ���˫������1���Ҽ���1���м���N2H2�����к���3���Ҽ���1���м���
�����Ե�ԭ���ӻ���ʽΪΪsp3�ӻ�����4��OԪ�ؿ���HԪ���γɵ�ԭ�Ӹ����ȷֱ�Ϊ1��1��1��2�Ļ�����ֱ���H2O2��H2O��H2O2������H2O����֮���γ�������������ֻ������������Ȼ�������5��HԪ����NԪ�ؿ��γ�N2H2�����Ӿ���ƽ��ṹ��������ṹʽΪH��N=N��H������ȫ�ǦҼ���˫������1���Ҽ���1���м���N2H2�����к���3���Ҽ���1���м���












