题目内容
【题目】以黄铜矿(主要成分二硫化亚铁铜CuFeS2)为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是CuFeS2 + 4Fe3+ ![]() Cu2+ + 5Fe2+ + 2S。
Cu2+ + 5Fe2+ + 2S。
(1)该反应中,Fe3+体现________性。
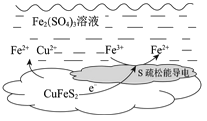
(2)上述总反应的原理如图所示。
负极的电极反应式是________。
(3)一定温度下,控制浸取剂pH = 1,取三份相同质量黄铜矿粉末分别进行如下实验:
实验 | 操作 | 2小时后Cu2+浸出率/% |
I | 加入足量0.10 mol·L-1 Fe2(SO4)3溶液 | 78.2 |
II | 加入足量0.10 mol·L-1 Fe2(SO4)3溶液,通入空气 | 90.8 |
III | 加入足量0.10 mol·L-1 Fe2(SO4)3溶液,再加入少量0.0005 mol·L-1 Ag2SO4溶液 | 98.0 |
①对比实验I、II,通入空气,Cu2+浸出率提高的原因是________。
②由实验III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+==Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+==2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005 mol·L-1 Ag2SO4溶液,充分混合后静置。取上层清液,加入稀盐酸,观察到溶液中________,证明发生反应i。
b.取少量Ag2S粉末,加入________溶液,充分混合后静置。取上层清液,加入稀盐酸,有白色沉淀,证明发生反应ii。
(4)用实验II的浸取液电解提取铜的原理如图所示:
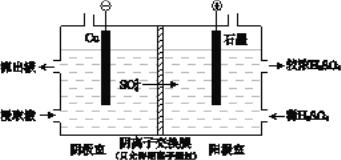
① 电解初期,阴极没有铜析出。用电极反应式解释原因是_______________。
② 将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是 _____________________。
【答案】 氧化 CuFeS2 - 4e-== Fe2+ + 2S + Cu2+ 通入O2后,Fe2+ 被氧化为Fe3+,c(Fe2+)降低,c(Fe3+)升高,平衡正向移动 无明显现象 Fe2(SO4)3溶液 Fe3+ + e-== Fe2+ Fe2+在阳极失电子生成Fe3+ , SO42- 通过阴离子交换膜进入阳极室,Fe2(SO4)3溶液再生
【解析】(1)本题考查氧化还原反应中的几个概念,根据离子反应方程式,Fe3+→Fe2+,化合价降低,因此Fe3+表现氧化性;(2)本题考查原电池的电极反应式的书写,根据原电池的工作原理,失电子的一极为负极,因此CuFeS2作负极,其电极反应式为CuFeS2-4e-=Fe2++2S+Cu2+;(3)考查影响化学反应速率和化学平衡移动的因素,①根据氧气把Fe2+氧化成Fe3+,根据上述反应方程式,减少c(Fe2+),促使平衡向正反应方向移动;②a、根据反应方程式,取上层清液,加入稀盐酸,没有沉淀产生,说明溶液中不含Ag+,即说明i发生;b、根据ii反应,需要加入Fe2(SO4)3溶液;(4)本题考查电极反应式的书写,①实验II中,加入过量Fe2(SO4)3溶液,Fe3+过量,因为Fe3+的氧化性强于Cu2+,因此Fe3+先放电,即Fe3++e-=Fe2+;②阳极上发生Fe2+-e-=Fe3+,Fe2+在阳极失电子生成Fe3+ , SO42- 通过阴离子交换膜进入阳极室,Fe2(SO4)3溶液再生。

 阅读快车系列答案
阅读快车系列答案【题目】用如图装置实验,下列实验现象预期及相应结论均正确的是( )
a | b | 实验现象预期 | 结论 | |
A | 铜丝 | 浓硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 |
B | 木条 | 18.4mol/L硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |

A.A
B.B
C.C
D.D