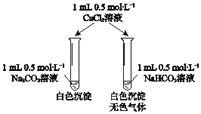
题目内容
【题目】X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.
请回答下列问题:
(1)X2分子中σ键和π键数目比是 .
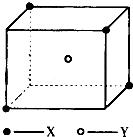
(2)R的晶胞结构如图所示,该晶胞中所含的原子个数是 . 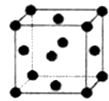
(3)下列有关X、Y、W的说法正确的是 .
①X的第一电离能在同族元素中最小
②常温下,Y的氢化物分子间存在氢键
③XY3﹣中X的杂化轨道类型为sp3杂化
④W属于d区的元素
(4)将X的气态氢化物的水溶液滴入R的氢氧化物悬浊液中,可得深蓝色溶液,该反应的离子方程是 .
(5)将Na2Y2与W2+的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,该反应的离子方程式是 .
(6)与X3﹣互为等电子体的分子有、离子有 .
【答案】
(1)1:2
(2)4
(3)②④
(4)Cu(OH)2+4NH3 . H2O=[Cu(NH3)4]2++2OH﹣+4H2O
(5)4Na2O2+Fe2++6H2O=4Fe(OH)3↓+O2↑+8Na+
(6)N2O或CO2或CS2或BeCl2;SCN﹣或OCN﹣或CNO﹣
【解析】解:X、Y、Z、W、R均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,即核外电子数为7,则X为N元素;W3+的基态离子3d轨道为半充满状态,离子核外电子排布为1s22s22p63s23p63d5 , 则W原子核外电子数为23+3=26,故W为Fe;R的氢氧化物悬浊液可用于检验葡萄糖的存在,则R为Cu;Y原子最外层有2对成对电子,外围电子排布为ns2np4 , 处于ⅥA族,Z的原子序数为Y的原子序数的2倍,结合原子序数可知,Y为O元素、Z为S元素。
(1.)N2分子结构式为N≡N,分子中σ键和π键数目比=1:2,所以答案是:1:2;
(2.)R原子处于晶胞的面心及顶角,该晶胞中所含的原子个数=6× ![]() +8×
+8× ![]() =4,所以答案是:4;
=4,所以答案是:4;
(3.)①X为N元素,其第一电离能在同族元素中最大,故①错误;②氧元素的氢化物为水或过氧化氢,常温下,分子间存在氢键,故②正确;③NO3﹣中N原子价层电子对数=3+ ![]() =3,N原子的杂化轨道类型为sp2杂化,③错误;④W为Fe,外围电子排布为3d64s2 , 属于d区的元素,故④正确,所以答案是:②④;
=3,N原子的杂化轨道类型为sp2杂化,③错误;④W为Fe,外围电子排布为3d64s2 , 属于d区的元素,故④正确,所以答案是:②④;
(4.)氨水滴入氢氧化铜悬浊液中,可得深蓝色溶液,该反应的离子方程是Cu(OH)2+4NH3 . H2O=[Cu(NH3)4]2++2OH﹣+4H2O,所以答案是:Cu(OH)2+4NH3 . H2O=[Cu(NH3)4]2++2OH﹣+4H2O;
(5.)将Na2O2与Fe2+的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,该反应的离子方程式是4Na2O2+Fe2++6H2O=4Fe(OH)3↓+O2↑+8Na+ , 所以答案是:4Na2O2+Fe2++6H2O=4Fe(OH)3↓+O2↑+8Na+;
(6.)X为N元素,N3﹣含有3个原子,电子数为22,互为等电子体的分子有N2O或CO2或CS2或BeCl2、离子有 SCN﹣或OCN﹣或CNO﹣ , 所以答案是:N2O或CO2或CS2或BeCl2; SCN﹣或OCN﹣或CNO﹣ .