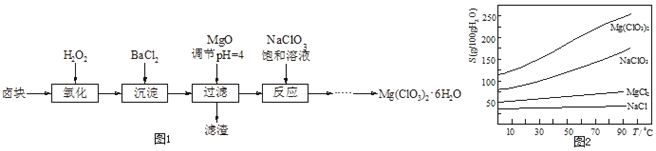
��Ŀ����
����Ŀ����֪A��B��C��D��E��F��G����Ԫ�����ڱ��ж���������Ԫ�أ����ǵ�ԭ��������������A��Ԫ�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�D3B�����������Ӿ�����ͬ�ĵ��Ӳ�ṹ��Bԭ��������Ӳ��p�ܼ����ڰ���״̬��Cԭ��������p�ܼ���������s�ܼ���������2����C��F����ͬһ���壬E���������������ڲ��1���ش��������⣺
��1��EԪ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ___��
��2���õ����Ų�ͼ��ʾFԪ��ԭ�ӵļ۵����Ų���____��
��3��F��GԪ�ض�Ӧ����ۺ����������Խ�ǿ����___(�ѧʽ)��
��4�����Ӱ뾶��D+___(����<����>��������������ͬ)B3-����һ�����ܣ�B___C���縺�ԣ�C__F��
��5��A��C�γɵ�һ����ɫ������X�й㷺Ӧ�ã�X������A��Cԭ�Ӹ�����Ϊ1��1��X�ĵ���ʽΪ___����д��Cu��ϡ������X��Ӧ�Ʊ�����ͭ�����ӷ���ʽ��__��
��6��д��E�ĵ�����D������������Ӧ��ˮ���ﷴӦ�Ļ�ѧ����ʽ��____��
���𰸡�1s22s22p63s23p1 ![]() HClO4 < > >
HClO4 < > > ![]() Cu+2H++H2O2=Cu2++2H2O 2Al+2H2O+2NaOH=2NaAlO2+3H2��
Cu+2H++H2O2=Cu2++2H2O 2Al+2H2O+2NaOH=2NaAlO2+3H2��
��������
![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ����Ԫ�����ڱ��ж���������Ԫ�أ����ǵ�ԭ��������������
����Ԫ�����ڱ��ж���������Ԫ�أ����ǵ�ԭ��������������![]() �����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ���
�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ��� ![]() ��
�� ![]() Ԫ�أ�
Ԫ�أ�![]() �����������Ӿ�����ͬ�ĵ��Ӳ�ṹ��
�����������Ӿ�����ͬ�ĵ��Ӳ�ṹ��![]() ԭ��������Ӳ��
ԭ��������Ӳ�� ![]() �ܼ��ϵĵ��Ӵ��ڰ���״̬��Ϊ��VA ��Ԫ�أ�
�ܼ��ϵĵ��Ӵ��ڰ���״̬��Ϊ��VA ��Ԫ�أ�![]() Ϊ
Ϊ ![]() �ۡ�
�ۡ�![]() Ϊ
Ϊ ![]() ����
���� ![]() �ǽ���Ԫ�أ�
�ǽ���Ԫ�أ�![]() ��ԭ����������
��ԭ���������� ![]() ��
��![]() ����
���� ![]() Ϊ
Ϊ ![]() Ԫ�ء�
Ԫ�ء�![]() Ϊ
Ϊ ![]() Ԫ�أ�Cԭ��������p�ܼ���������s�ܼ���������2������
Ԫ�أ�Cԭ��������p�ܼ���������s�ܼ���������2������ ![]() ��
�� ![]() Ԫ�أ�
Ԫ�أ�![]() ��
��![]() ��ͬһ���壬��
��ͬһ���壬�� ![]() ��
�� ![]() Ԫ�أ�
Ԫ�أ�![]() ���������������ڲ��
���������������ڲ�� ![]() ����
���� ![]() ����������Ϊ
����������Ϊ ![]() ��
��![]() ��
�� ![]() Ԫ�أ�
Ԫ�أ�![]() ��ԭ����������
��ԭ���������� ![]() ����Ϊ����������Ԫ�أ���
����Ϊ����������Ԫ�أ��� ![]() ��
�� ![]() Ԫ�ء�
Ԫ�ء�
��1��ͨ�����Ϸ���֪��![]() ��
�� ![]() Ԫ�أ���ԭ�Ӻ����� 13 �����ӣ����ݹ���ԭ��֪���̬ԭ�Ӻ�������Ų�ʽΪ
Ԫ�أ���ԭ�Ӻ����� 13 �����ӣ����ݹ���ԭ��֪���̬ԭ�Ӻ�������Ų�ʽΪ ![]() ��
��
��2��![]() Ϊ
Ϊ ![]() Ԫ�أ���۵���Ϊ
Ԫ�أ���۵���Ϊ ![]() ��
��![]() ���ӣ���۵����Ų�ͼΪ
���ӣ���۵����Ų�ͼΪ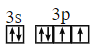 ��
��
��3��Ԫ�صķǽ�����Խǿ��������������ˮ��������Խǿ��![]() Ԫ�صķǽ����Դ���
Ԫ�صķǽ����Դ��� ![]() Ԫ�أ���
Ԫ�أ��� ![]() Ԫ�ض�Ӧ����ۺ����������Խ�ǿ�ķ���ʽΪ
Ԫ�ض�Ӧ����ۺ����������Խ�ǿ�ķ���ʽΪ ![]() ��
��
��4�����Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ���������������С���������Ӱ뾶 ![]() ��
��![]() ��
�� ![]() Ԫ�ء�
Ԫ�ء�![]() ��
�� ![]() Ԫ�أ�ͬһ����Ԫ���У�Ԫ�ص�һ����������ԭ����������������������ƣ�������
Ԫ�أ�ͬһ����Ԫ���У�Ԫ�ص�һ����������ԭ����������������������ƣ�������![]() ��Ԫ�ص�һ�����ܴ�������Ԫ�أ����Ե�һ������
��Ԫ�ص�һ�����ܴ�������Ԫ�أ����Ե�һ������ ![]() ��
��![]() ��
�� ![]() Ԫ�ء�
Ԫ�ء�![]() ��
�� ![]() Ԫ�أ�ͬһ����Ԫ���У��縺������ԭ���������������С�����Ե縺��
Ԫ�أ�ͬһ����Ԫ���У��縺������ԭ���������������С�����Ե縺�� ![]() ��
��
��5��![]() ��
��![]() �γɵ�һ����ɫ������
�γɵ�һ����ɫ������ ![]() �й㷺Ӧ�ã�
�й㷺Ӧ�ã�![]() ������
������ ![]() ��
��![]() ԭ�Ӹ����� 1:1����
ԭ�Ӹ����� 1:1���� ![]() ��˫��ˮ�������ʽΪ
��˫��ˮ�������ʽΪ![]()
![]() �����������£�˫��ˮ��ͭ����Ϊͭ���ӣ����ӷ���ʽΪ
�����������£�˫��ˮ��ͭ����Ϊͭ���ӣ����ӷ���ʽΪ ![]() ��
��
��6��![]() ������������ˮ������
������������ˮ������ ![]() ����������������Һ��Ӧ����ƫ�����ƺ���������Ӧ����ʽʽΪ
����������������Һ��Ӧ����ƫ�����ƺ���������Ӧ����ʽʽΪ ![]() ��
��

����Ŀ�����ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e��ԭ��������������a��b�����������������Ԫ�أ�c�ǵؿ��к�������Ԫ�أ�d��bͬ�壬e2+���ӵ�3d�������9�����ӡ��ش��������⣺
(1)c��d����Ԫ���γɵĻ�����ͳ�ƹ�ʯ����ͨ��______________����������ᾧ�κ����ε����ִ�����̬��c�ļ۵����Ų�ͼΪ______________________________��
(2)A��B�����������ֳ������л��A����CaCO3��Ӧ�������ڳ�����ˮ����B�����е�̼ԭ����Ŀ��A����ͬ�������Ʒ�Ӧ�ų����塣B�д��ڵĻ�ѧ��������______��
A.���Ӽ� B.���ۼ� C.������ D.���
A������̼ԭ�ӵĹ���ӻ�������___________��
(3)����>������<����գ�
��һ������ | �۵� |
b___d | dc2����___d���� |
(4)c��e����Ԫ�ؿ��γ�һ�ְ뵼����ϣ���ѧʽΪe2c���������������ڲ����ĸ�cԭ�ӣ�����cԭ��λ�����ĺͶ��㣬��þ�������____��eԭ�ӡ�
(5)��e2+�����ε�ˮ��Һ�м�������İ�ˮ���ɵõ�����ɫ����Һ��д�����������ӵĽṹ______________(Ҫ����λ��)��