题目内容
【题目】氯酸镁![]() 常用作催熟剂、除草剂等,实验室制备少量
常用作催熟剂、除草剂等,实验室制备少量![]() 的流程如图1:
的流程如图1:
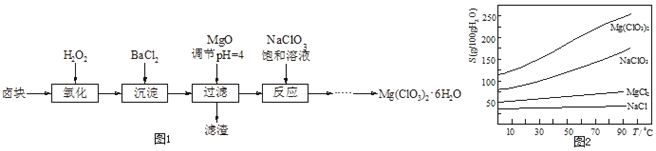
已知:
![]() 卤块主要成分为
卤块主要成分为![]() ,含有
,含有![]() 、
、![]() 等杂质;
等杂质;
![]() 几种化合物的溶解度
几种化合物的溶解度![]() 随温度
随温度![]() 变化曲线如图2.
变化曲线如图2.
![]() 加MgO后过滤所得滤渣的主要成分为______.
加MgO后过滤所得滤渣的主要成分为______.
![]() 加入
加入![]() 的目的是除去
的目的是除去![]() ,如何检验
,如何检验![]() 已沉淀完全______.
已沉淀完全______.
![]() 加入
加入![]() 饱和溶液会发生如下反应:
饱和溶液会发生如下反应:![]() ,请利用该反应,结合图1,制取
,请利用该反应,结合图1,制取![]() 的实验步骤依次为:
的实验步骤依次为:
![]() 取样,加入
取样,加入![]() 饱和溶液充分反应;
饱和溶液充分反应;
![]() ______;
______;
![]() ______;
______;
![]() ______;
______;
![]() 过滤、洗涤,获得
过滤、洗涤,获得![]() 晶体.
晶体.
产品中![]() 含量的测定:
含量的测定:
步骤1:准确称量![]() 产品溶解定容成100mL溶液.
产品溶解定容成100mL溶液.
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和![]() 的
的![]() 溶液,微热.
溶液,微热.
步骤3:冷却至室温,用![]() 溶液滴定至终点,此过程中反应的离子方程式为:
溶液滴定至终点,此过程中反应的离子方程式为:![]()
步骤4:将步骤2、3重复两次,平均消耗![]() 溶液
溶液![]() .
.
![]() 上述产品测定中需要检查是否漏液的仪器有______
上述产品测定中需要检查是否漏液的仪器有______![]() 步骤3中若滴定前不用标准液润洗滴定管,会导致最终结果偏______
步骤3中若滴定前不用标准液润洗滴定管,会导致最终结果偏______![]() 填“大”或“小”
填“大”或“小”![]() .
.
![]() 产品中
产品中![]() 的质量分数为______
的质量分数为______![]() 计算结果保留两位小数
计算结果保留两位小数![]()
【答案】![]() 和
和![]() 静置,取上层清液加入
静置,取上层清液加入![]() ,若无白色沉淀,则
,若无白色沉淀,则![]() 沉淀完全 蒸发结晶 趁热过滤 冷却结晶 容量瓶、滴定管 小
沉淀完全 蒸发结晶 趁热过滤 冷却结晶 容量瓶、滴定管 小 ![]()
【解析】
卤块主要成分为MgCl2.6H2O,含有MgSO4、FeCl2等杂质,加入氧化剂过氧化氢氧化亚铁离子为铁离子,加入氯化钡溶液生成硫酸钡沉淀,加入氧化镁,调节溶液的pH为4,此时铁离子形成了沉淀氢氧化铁,加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl↓过滤,得到Mg(ClO3)2溶液中,根据物质的溶解度大小,溶液获得晶体的方法:蒸发结晶、过滤、冷却结晶制取Mg(ClO3)26H2O,
(1)根据加氧化镁后可以调节pH值,使溶液的pH为4,可以沉淀的离子来判断滤渣的主要成分;
(2)根据钡离子可以和硫酸根离子之间反应生成白色不溶于硝酸的白色沉淀来检验已沉淀完全;
(3)根据物质的溶解度大小,溶液获得晶体的方法:蒸发浓缩,趁热过滤,冷却结晶、过滤、洗涤、干燥;
(4)带有旋塞、活塞等部件的仪器容量瓶、滴定管使用之前必须查漏,并且滴定前要用标准液润洗滴定管,否则会将标准液稀释,实验计算的剩余亚铁离子的物质的量结果会偏高,则反应掉的会偏小;
(5)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价;根据化学反应ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,根据各个质物之间的关系式可计算百分含量。
![]() 调节溶液的pH为4,此时铁离子形成了沉淀氢氧化铁,钡离子已经和硫酸根离子只碱反应生成了硫酸钡沉淀,故答案为:
调节溶液的pH为4,此时铁离子形成了沉淀氢氧化铁,钡离子已经和硫酸根离子只碱反应生成了硫酸钡沉淀,故答案为:![]() 和
和![]() ;
;
![]() 检验硫酸根离子是否除净的方法:静置,取上层清液加入
检验硫酸根离子是否除净的方法:静置,取上层清液加入![]() ,若无白色沉淀,则
,若无白色沉淀,则![]() 沉淀完全,故答案为:静置,取上层清液加入
沉淀完全,故答案为:静置,取上层清液加入![]() ,若无白色沉淀,则
,若无白色沉淀,则![]() 沉淀完全;
沉淀完全;
![]() 根据物质的溶解度大小,溶液获得晶体的方法:蒸发结晶、过滤、冷却结晶,故答案为:蒸发结晶;趁热过滤;冷却结晶;
根据物质的溶解度大小,溶液获得晶体的方法:蒸发结晶、过滤、冷却结晶,故答案为:蒸发结晶;趁热过滤;冷却结晶;
![]() 带有旋塞、活塞等部件的仪器容量瓶、滴定管使用之前必须查漏,并且滴定前要用标准液润洗滴定管,否则会将标准液稀释,实验计算的剩余亚铁离子的物质的量结果会偏高,则反应掉的会偏小,
带有旋塞、活塞等部件的仪器容量瓶、滴定管使用之前必须查漏,并且滴定前要用标准液润洗滴定管,否则会将标准液稀释,实验计算的剩余亚铁离子的物质的量结果会偏高,则反应掉的会偏小,![]() 的含量测定结果偏小,故答案为:容量瓶、滴定管;小;
的含量测定结果偏小,故答案为:容量瓶、滴定管;小;
![]() 氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:
氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:![]() ,根据化学方程式:
,根据化学方程式:![]() 以及
以及![]() ,可以得出:
,可以得出:
![]() ,
,![]() ,用
,用![]()
![]() 溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:
溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:![]() ,和氯酸根离子反应的亚铁离子的物质的量为:
,和氯酸根离子反应的亚铁离子的物质的量为:![]() ,
,
氯酸根离子的物质的量为:![]() ,产品中
,产品中![]() 的质量分数:
的质量分数:![]() ;
;
故答案为:![]() 。
。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
【题目】下表列出了①~⑩十种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ④ | ⑩ | |||||
3 | ⑤ | ⑥ | ⑦ | ③ | ⑧ | ⑨ | ||
回答下列问题:
(1)①、④按原子个数比1:1 组成的分子的电子式为____________________ ;由②、④两种元素组成的一种无毒化合物的结构式为 _____________________。
(2)这10种元素中,化学性质最不活泼的元素是_____________(填元素符号,下同),得电子能力最强的原子是__________________,失电子能力最强的单质与水反应的化学方程式是_________________________。
(3)用化学方程式表示②和⑨两种元素的非金属性强弱:________________________ 。
(4)元素③的气态氢化物和元素⑧的气态氢化物中,易于制备的是 ____________________(填化学式)
(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应,其离子方程式为 ______________________________。
(6)元素 ①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式:___________________ ;写出一种离子化合物的化学式:______________________。
(7)写出⑥的单质置换出②的单质的化学方程式:________________________。