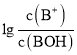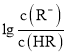题目内容
【题目】氧和硫的化合物在化工生产上应用非常广泛.试回答下列问题:
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。
己知:6Ag(s)+O3(g)═3Ag2O(s);△H=﹣235kJ/mol;
2Ag2O(s)═4Ag(s)+O2(g);△H=+60kJ/mol;
则反应2O3(g)=3O2(g)的△H=___。
(2)SO2Cl2常用于制造医药品、染料、表面活性剂等.已知:SO2Cl2(g)![]() SO2(g)+Cl2(g)△H=akJmol﹣1。300℃时向体积为2L的恒容密闭容器中充入0.20molSO2Cl2,达到平衡时,容器中含0.1molSO2,该温度时反应的平衡常数为___。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为___。
SO2(g)+Cl2(g)△H=akJmol﹣1。300℃时向体积为2L的恒容密闭容器中充入0.20molSO2Cl2,达到平衡时,容器中含0.1molSO2,该温度时反应的平衡常数为___。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为___。
(3)对(2)中的反应,在400℃,1.01×105Pa条件下,向容积为2L的恒容密闭容器中充入一定量的SO2Cl2,n(SO2)和n(SO2Cl2)随时间的变化曲线如图所示。
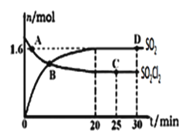
①0~20min反应的平均速率v(SO2Cl2)=___。△H___0(填“<”“>”或“=”)其原因是:___。
②下列叙述正确的是___。
A.A点v正(SO2Cl2)>v逆(SO2Cl2)
B.密度和平均摩尔质量不变均说明处于平衡状态
C.其它条件不变,若增大压强,n(SO2)比图中D点的值大
D.其它条件不变,500℃时反应达平衡,n(SO2)比图中D点的值大
【答案】﹣290kJ/mol 0.05mol/L 46.6g 0.04mol/(L.min) > 升高温度,平衡常数增大,所以正反应是吸热反应 AD
【解析】
(1)①6Ag(s)+O3(g)═3Ag2O(s);△H=﹣235kJ/mol;
②2Ag2O(s)═4Ag(s)+O2(g);△H=+60kJ/mol;
根据盖斯定律,①×2+②×3可得到2O3(g)=3O2(g),反应热![]() ;
;
(2)![]() ,
,![]() ,平衡常数
,平衡常数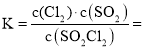
![]() ;根据S原子的守恒计算生成硫酸钡的质量,
;根据S原子的守恒计算生成硫酸钡的质量,![]()
![]() ;
;
(3)①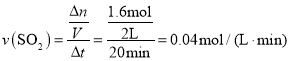 ,同一可逆反应中同一时间段内,各物质的反应速率之比等于其化学计量数之比,所以v(SO2Cl2)=v(
,同一可逆反应中同一时间段内,各物质的反应速率之比等于其化学计量数之比,所以v(SO2Cl2)=v(![]() )=
)=![]() ;由于升高温度,平衡常数增大,所以正反应是吸热反应;
;由于升高温度,平衡常数增大,所以正反应是吸热反应;
②A. A点平衡向正反应方向移动,说明正反应速率大于逆反应速率,A正确;
B. 因为反应前后质量不变,体积不变,所以密度一直不变,则密度不再改变不能说明反应达到平衡,B错误;
C. 增大压强,平衡向气体体积减小的方向移动,即向逆反应方向移动,所以![]() 减小,C错误;
减小,C错误;
D. 其他条件不变,升高温度,平衡正向移动,平衡时![]() 增大,所以
增大,所以![]() 比图中D大,D正确;
比图中D大,D正确;
故答案选AD。

【题目】几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
A.X、W元素的离子半径 W<X
B.一定条件下,W单质可以与Z元素的氢化物发生化学反应
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,Z单质与W的常见单质直接生成ZW2