题目内容
14.有下列几种物质:①Ne、②NH4Cl、③NaOH、④Cl2、⑤CO2、⑥H2O、⑦Na2O2.(1)上述物质中,属于共价化合物的是⑤⑥(填序号,下同),既存在离子键又存在极性键的是②③
(2)②号物质的电子式为
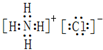 、用电子式表示⑥号物质的形成过程:
、用电子式表示⑥号物质的形成过程: .
.
分析 (1)含共价键的化合物为共价化合物,含离子键的一定为离子化合物,离子化合物中可存在非极性共价键;
(2)氯化铵为离子化合物,水为共价化合物.
解答 解:(1)因一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间形成共价键.所以②、③、⑤含有极性键,②、③中含有离子键和极性键,④中含有非极性键,⑥中含有离子键和非极性键,①中无化学键,含有离子键的化合物就是离子化合物,全部由共价键形成的化合物是共价化合物,所以⑤⑥是共价化合物,既存在离子键又存在非极性键的是⑦,
故答案为:⑤⑥;②③;
(2)NH4Cl是离子化合物,由铵根离子和氯离子构成,其电子式为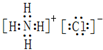 ;
;
H2O是由2个H原子和1个O原子通过形成共用电子对形成的,形成过程为: ,
,
故答案为: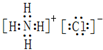 ;
; .
.
点评 本题考查化学键,为高考高频考点,把握化学键与化合物的关系为解答的关键,注意电子式的书写及化合物形成过程,注重基础知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列文字表述与反应的离子方程式对应且正确的是( )
| A. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| B. | Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-═9Fe3++NO2↑+14H2O | |
| C. | NaHSO4溶液与Ba(OH)2溶液混合后显中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O |
5.短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或者C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和.下列说法正确的是( )
| A. | 元素B和E的最高价氧化物对应的水化物均为强酸 | |
| B. | A、B的气态氢化物的稳定性:A>B | |
| C. | 元素C、D、E的最高价氧化物对应的水化物之间均可相互反应 | |
| D. | 工业上常用电解元素C、D的氯化物来制取它们的单质 |
9.C、N、S都是重要的非金属元素.下列说法正确的是( )
| A. | 三者对应的氧化物均为酸性氧化物 | |
| B. | 同浓度的Na2CO3、NaNO3、Na2SO3溶液的pH:NaNO3<Na2SO3<Na2CO3 | |
| C. | 三者的单质直接与氧气反应都能生成两种以上氧化物 | |
| D. | CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
3.下列各组大小顺序不正确的是( )
| A. | 粒子半径:Na+>Mg2+>S2->Cl- | B. | 热稳定性:SiH4<PH3<H2S<HCl | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性:HF<HCl<HBr<HI |
4.下列有机物中,既能发生消去反应,又能发生酯化反应,还能发生催化氧化,且催化氧化产物能发生银镜反应的是( )
| A. | CH3OH | B. | CH3CH(OH)COOH | C. | (CH3)2C(OH)CH2CH3 | D. | HOCH2CH2COOH |