题目内容
6.北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).(1)丙烷脱氢可得丙烯.
已知:C3H8(g)═CH4(g)+HC≡CH(g)+H2(g);△H1=156.6kJ•mol-1
CH3CH=CH2(g)═CH4(g)+HC≡CH(g);△H2=32.4kJ•mol-1
则相同条件下,反应C3H8(g)=CH3CH=CH2 (g)+H2(g)的△H=124.2kJ•mol-1.
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐.电池反应方程式为C3H8+5O2=3CO2+4H2O.
(3)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol•L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3-+H+的平衡常数K1=4.2×10-7 mol•L-1.(已知:10-5.60=2.5×10-6)
(4)常温下,0.1mol•L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)>c(CO32-)
(填“>”、“=”或“<”).
分析 (1)根据盖斯定律,由已知热化学方程式乘以合适的系数进行加减构造目标目标热化学方程式,反应热也乘以相应的系数,进行相应的加减,据此计算;
(2)负极通入丙烷,碳元素的化合价升高,电池的正极通入O2,氧元素的化合价降低,即丙烷与氧气反应生成二氧化碳和水,以此来书写电池总反应方程式;
(3)依据平衡常数概念结合平衡状态下离子浓度和同时浓度计算得到;
(4)根据NaHCO3溶液的中HCO3-的水解程度大于自身的电离程度来回答.
解答 解:(1)已知:①C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ•mol-1
②CH3CH=CH2(g)═CH4(g)+HC≡CH(g )△H2=32.4kJ•mol-1
根据盖斯定律,①-②得C3H8(g)═CH3CH=CH2(g)+H2(g),所以△H=△H1-△H2=156.6kJ•mol-1-32.4kJ•mol-1=124.2kJ•mol-1;
故答案为:124.2;
(2)负极通入丙烷,碳元素的化合价升高,电池的正极通入O2,氧元素的化合价降低,即丙烷与氧气反应生成二氧化碳和水,则电池的总反应为C3H8+5O2═3CO2+4H2O;
故答案为:C3H8+5O2═3CO2+4H2O;
(3)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H+)=c(HCO3-)=10-5.6mol/L;c(H2CO3)=1.5×10-5 mol•L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3的第一级电离的平衡常数K1=$\frac{c(H{\;}^{+})•c(HCO{\;}_{3}{\;}^{-})}{c(H{\;}_{2}CO{\;}_{3})}$=$\frac{10{\;}^{-5.6×}10{\;}^{-5.6}}{1.5×10{\;}^{-5}}$=4.2×10-7 mol•L-1,故答案为:4.2×10-7 mol•L-1;
(4)因NaHCO3溶液显碱性,HCO3-的水解程度大于自身的电离程度,即NaHCO3溶液中既存在电离平衡为HCO3-?CO32-+H+,水解平衡为HCO3-+H2O?H2CO3+OH-,而HCO3-水解程度大于电离程度,
故答案为:>.
点评 本题考查盖斯定律、燃料电池的工作原理、弱电解质平衡常数的计算、盐类水解的分析,题目难度中等,侧重于考查学生对基础知识的应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | 碳酸氢钠受热分解 | B. | 氨气与氯化氢气体反应 | ||
| C. | C(s,石墨)+H2O(g)═CO(g)+H2(g) | D. | 液态水气化 |
| X | ||
| Y | ||
| Z |
(2)B的氢化物的分子空间构型是三角锥型.其中心原子采取sp3杂化.
(3)写出化合物AC2的电子式
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.(4)ECl3与B、C的氢化物形成配位数为六的配合物的化学式为[Cr(NH3)4(H2O)2]Cl3.
| A. | 原子序数:X>Y>Z>W | B. | 简单离子半径:W>Y>Z>X | ||
| C. | 原子半径:W>Y>Z>X | D. | 原子的得电子能力:X<Z |
①中和滴定用的锥形瓶;
②中和滴定用的滴定管;
③容量瓶;
④配制一定量、一定物质的量浓度的NaOH溶液,用于称量的小烧杯;
⑤量筒(中和热测定);
⑥移液管(量取醋酸).
| A. | ①②⑥ | B. | ①③ | C. | ①③⑤ | D. | ②④⑥ |
| A. | 0.1mol | B. | 0.15mol | C. | 0.25mol | D. | 0.3mol |

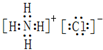 、用电子式表示⑥号物质的形成过程:
、用电子式表示⑥号物质的形成过程: .
.
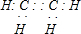 .
.