题目内容
3.下列各组大小顺序不正确的是( )| A. | 粒子半径:Na+>Mg2+>S2->Cl- | B. | 热稳定性:SiH4<PH3<H2S<HCl | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性:HF<HCl<HBr<HI |
分析 A.电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强;
D.元素的非金属性越强,其氢化物的还原性越弱.
解答 解:A.电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,Na+、Mg2+有两个电子层、S2-和Cl-有3个电子层,所以离子半径S2->Cl-Na+>Mg2+,故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>S>P>Si,所以氢化物的稳定性SiH4<PH3<H2S<HCl,故B正确;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性K>Na>Li,所以碱性KOH>NaOH>LiOH,故C正确;
D.元素的非金属性越强,其氢化物的还原性越弱,非金属性F>Cl>Br>I,所以还原性:HF<HCl<HBr<HI,故D正确;
故选A.
点评 本题考查元素周期律,侧重考查学生分析判断能力,明确同一周期、同一主族元素原子结构及其性质递变规律即可解答,注意离子半径大小比较方法,题目难度不大.

练习册系列答案
相关题目
13.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 | Ksp:CaCO3<CaSO4 |
| B | 用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成 | 该电极为阳极 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 氧化性:Cu2+>Fe3+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有Ag+ |
| A. | A | B. | B | C. | C | D. | D |
11.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为C<O<N.
(2)B的氢化物的分子空间构型是三角锥型.其中心原子采取sp3杂化.
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
(4)ECl3与B、C的氢化物形成配位数为六的配合物的化学式为[Cr(NH3)4(H2O)2]Cl3.
| X | ||
| Y | ||
| Z |
(2)B的氢化物的分子空间构型是三角锥型.其中心原子采取sp3杂化.
(3)写出化合物AC2的电子式
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.(4)ECl3与B、C的氢化物形成配位数为六的配合物的化学式为[Cr(NH3)4(H2O)2]Cl3.
18.X、Y、Z、W为四种短周期元素,已知X、Z同主族,Y、Z、W同周期;X的气态氢化物比Z的稳定;Y的阳离子比W的阳离子氧化性强;Y的阳离子比Z的阴离子少一个电子层.下列表示中,正确的是( )
| A. | 原子序数:X>Y>Z>W | B. | 简单离子半径:W>Y>Z>X | ||
| C. | 原子半径:W>Y>Z>X | D. | 原子的得电子能力:X<Z |
15.以下仪器、用蒸馏水洗净后便可立即使用而不会对实验结果造成误差的是( )
①中和滴定用的锥形瓶;
②中和滴定用的滴定管;
③容量瓶;
④配制一定量、一定物质的量浓度的NaOH溶液,用于称量的小烧杯;
⑤量筒(中和热测定);
⑥移液管(量取醋酸).
①中和滴定用的锥形瓶;
②中和滴定用的滴定管;
③容量瓶;
④配制一定量、一定物质的量浓度的NaOH溶液,用于称量的小烧杯;
⑤量筒(中和热测定);
⑥移液管(量取醋酸).
| A. | ①②⑥ | B. | ①③ | C. | ①③⑤ | D. | ②④⑥ |
12.下列说法中错误的是( )
| A. | 只要是甜的物质,都是糖类 | |
| B. | 单糖是不能发生水解的最简单的糖类 | |
| C. | 淀粉纤维素都是天然有机高分子化合物 | |
| D. | 蔗糖和麦芽糖均为二糖 |
13.下列物质不能发生消去反应的是( )
| A. | 溴乙烷 | B. | 2-甲基-1-丙醇 | ||
| C. | 2-丙醇 | D. | 2,2-二甲基-1-丙醇 |
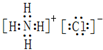 、用电子式表示⑥号物质的形成过程:
、用电子式表示⑥号物质的形成过程: .
.