题目内容
【题目】下列根据实验操作和实验现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将FeCl2样品溶于盐酸后,滴加KSCN溶液 | 溶液变成红色 | 原FeCl2样品已变质 |
B | 将Na2SO3样品溶于水,滴加入稀盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | 原Na2SO3样品已变质 |
C | 向淀粉KI溶液中滴入3滴稀硫酸,再加入10%的H2O2溶液 | 滴入稀硫酸未见溶液变蓝;加入H2O2溶液后,溶液立即变蓝 | 酸性条件下,H2O2氧化性强于I2 |
D | 向5mL0.5mol/LNaHCO3溶液中滴入2mL1mol/LBaCl2溶液 | 产生白色沉淀,且有无色气体生成 | 反应的化学方程式为2NaHCO3+BaCl2=BaCO3↓+ 2NaCl+CO2↑+H2O |
A. AB. BC. CD. D
【答案】B
【解析】
A、将FeCl2样品溶于盐酸后,滴加KSCN溶液,溶液变红,说明溶液中含有Fe3+,即原FeCl2样品已变质,故A说法正确;
B、NO3-在酸性条件下具有强氧化性,能将SO32-氧化成SO42-,产生白色沉淀,但不能说明Na2SO3已变质,故B说法错误;
C、淀粉遇碘单质变蓝,淀粉KI溶液中滴入稀硫酸,未见溶液变蓝色,说明没有碘单质的生成,当加入H2O2溶液后,溶液立即变蓝,说明I-被H2O2氧化成I2,推出H2O2的氧化性强于I2,故C说法正确;
D、HCO3-在水中发生电离:HCO3-![]() H++CO32-,Ba2+与CO32-结合生成BaCO3沉淀,促使平衡向正反应方向进行,H+增多,H+与HCO3-发生反应生成CO2,即反应方程式为2NaHCO3+BaCl2=BaCO3↓+2NaCl+CO2↑+H2O,故D说法正确;
H++CO32-,Ba2+与CO32-结合生成BaCO3沉淀,促使平衡向正反应方向进行,H+增多,H+与HCO3-发生反应生成CO2,即反应方程式为2NaHCO3+BaCl2=BaCO3↓+2NaCl+CO2↑+H2O,故D说法正确;
答案为B。

【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
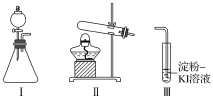
供选试剂:30%H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下
操作 | 现象 | |
甲 | 向I的锥形瓶中加入___,向I的____中加入30%H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/LH2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是____。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___。为进一步探究该条件对反应速率的影响,可采取的实验措施是___。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列_____(填字母)溶液,证明了白雾中含有H2O2。
A.酸性KMnO4 B.FeC12 C.Na2S D.品红
【题目】(1)已知Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.6×10-39。常温下,某酸性CuCl2溶液中含有少量的FeCl3,为了得到纯净的CuCl2·2H2O晶体,应加入___________(填氧化物的化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗涤液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
①用稀盐酸溶解碳酸钙的离子方程式是_____________________________。
②已知:25 ℃时有关物质的溶度积
物质 | CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
Ksp | 2.8×10-9 | 9.1×10-6 | 1.8×10-11 | 6.8×10-6 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程________________。(用溶解平衡表达式和必要的文字叙述加以说明);在步骤Ⅰ浸泡过程中还会发生反应MgCO3(s)+2OH-(aq)![]() Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=________(保留两位有效数字)。
Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=________(保留两位有效数字)。
③步骤Ⅲ中,加入Na2SO3溶液的目的是_______________________________。