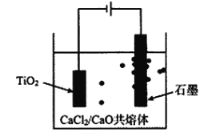
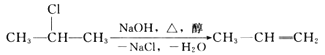题目内容
【题目】实验室里用如图所示仪器和药品先制取纯净干燥的氯气,再用氯气制备少量无水氯化铜(Cu+Cl2![]() CuCl2)。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长等部分未画出。根据要求填写下列各小题空白。
CuCl2)。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长等部分未画出。根据要求填写下列各小题空白。
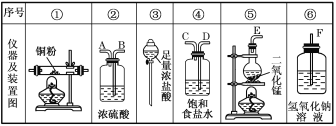
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)③接⑤接(____)接(____)接①接(____),其中②与④装置相连时,玻璃管接口(用装置中字母表示)应是____接____。
(2)③中仪器名称是___;装置④的作用是___;装置⑥的作用是____。
(3)实验开始时,应先检验装置的____,实验结束时,应先熄灭___处的酒精灯。
(4)在装置⑤的烧瓶中,发生反应的化学方程式为_____。
(5)若用含8 mol HCl的浓盐酸跟足量二氧化锰反应,产生氯气的物质的量应____(填“大于”、“等于”或“小于”)2 mol,原因是____。
【答案】④ ② ⑥ C B 分液漏斗 除去Cl2中的HCl气体 吸收多余的Cl2,防止Cl2逸出污染环境 气密性 ① MnO2+4HCl(浓)![]() Cl2↑+MnCl2+2H2O 小于 盐酸易挥发,且随着反应的进行盐酸浓度变稀,反应就会停止,所以8mol的HCl并未完全消耗
Cl2↑+MnCl2+2H2O 小于 盐酸易挥发,且随着反应的进行盐酸浓度变稀,反应就会停止,所以8mol的HCl并未完全消耗
【解析】
利用实验室制得的氯气与铜反应制取纯净氯化铜,因实验室制得的氯气中混有氯化氯和水汽,需要除去杂质,得到干燥的氯气再与铜在加热的情况下反应,为了得到纯净的氯化铜,在加热反应前需要将装置内的空气排出,形成无氧环境,同时要考虑氯气的尾气对环境有污染,需要用氢氧化钠溶液吸收除去。据此分析解答。
利用实验室制得的氯气与铜反应制取纯净氯化铜,因实验室制得的氯气中混有氯化氯和水汽,需要除去后得到干燥的氯气再与铜在加热的情况下反应,为了得到纯净的氯化铜,在加热反应前需要将装置内的空气排出,形成无氧环境,同时要考虑氯气的尾气对环境有污染,需要用氢氧化钠溶液除去,
(1)仪器的连接方法:先制备反应物,然后除杂质,再使氯气与铜反应,最后进行尾气处理;进行气体除杂或者干燥时,需要“长进短出”,根据题意,用浓盐酸与二氧化锰反应制备氯气,用饱和食盐水除去氯化氢,再用浓硫酸干燥,除杂后与铜反应生成氯化铜,尾气用氢氧化钠吸收,所以仪器的连接顺序为:③⑤④②①⑥,其中②与④装置相连时,玻璃管接口应是C接B,故答案为:④;②;⑥;C;B;
(2)根据图示,③中仪器为分液漏斗;装置④中盛装的是饱和食盐水可以除去氯气中的氯化氢,装置⑥中的氢氧化钠可以吸收尾气中的氯气,防止污染,故答案为:分液漏斗;除去氯气中混有的氯化氢;吸收多余的Cl2,防止Cl2逸出污染环境;
(3)实验中涉及气体的生成,实验开始时一般都要检验装置的气密性;为了防止空气中的成分的干扰,实验结束时,有铜粉的装置中还应再通一会儿氯气至硬质玻璃管冷却,所以实验结束时,应先熄灭①处的酒精灯,故答案为:气密性;①;
(4)装置⑤是利用二氧化锰和浓盐酸混合加热制氯气,发生反应的化学方程式为MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(5)若用含8 mol HCl的浓盐酸跟足量二氧化锰反应,随着反应的进行,盐酸的浓度逐渐减小,变成稀盐酸,反应不再进行,因此产生氯气的物质的量应小于2 mol,故答案为:小于;盐酸易挥发,且随着反应的进行盐酸浓度变稀,反应就会停止,所以8mol的HCl并未完全消耗。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案【题目】下列根据实验操作和实验现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将FeCl2样品溶于盐酸后,滴加KSCN溶液 | 溶液变成红色 | 原FeCl2样品已变质 |
B | 将Na2SO3样品溶于水,滴加入稀盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | 原Na2SO3样品已变质 |
C | 向淀粉KI溶液中滴入3滴稀硫酸,再加入10%的H2O2溶液 | 滴入稀硫酸未见溶液变蓝;加入H2O2溶液后,溶液立即变蓝 | 酸性条件下,H2O2氧化性强于I2 |
D | 向5mL0.5mol/LNaHCO3溶液中滴入2mL1mol/LBaCl2溶液 | 产生白色沉淀,且有无色气体生成 | 反应的化学方程式为2NaHCO3+BaCl2=BaCO3↓+ 2NaCl+CO2↑+H2O |
A. AB. BC. CD. D
【题目】金属是非常有用的材料,以下是四种金属的相关性质。
金属 | 熔点(℃) | 密度(g/cm3) | 相对强度 (1表示很弱) | 相对硬度 (1表示很软) | 每吨价格 (元) |
铝 | 660 | 2.7 | 11 | 2.8 | 11400 |
铜 | 1085 | 8.9 | 33 | 3.0 | 38000 |
铁 | 1538 | 7.9 | 20 | 4.5 | 4000 |
钛 | 1668 | 4.5 | 40 | 6.0 | 160000 |
完成下列填空:
(1)铝用作电线是利用了铝的_________性;铁用作炊具是利用了铁的_________性。
(2)工业上常以Cu为原料制备CuSO4,“绿色化学”要求从经济、技术和环保来设计可行的化学反应,生产应尽量减少对环境的副作用。下列反应符合“绿色化学”的是(_______)
A.Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑ + 2H2O
CuSO4 + SO2↑ + 2H2O
B.2Cu + O2![]() 2CuO,CuO + H2SO4→CuSO4 +H2O
2CuO,CuO + H2SO4→CuSO4 +H2O
(3)常温下由于浓硫酸能使铁___________,因此浓硫酸可用铁槽车运输。
(4)钛是制造飞机的材料之一。根据表中数据,解释为何用钛来制造飞机。______________
(5)钢是主要含有铁的合金。汽车车身可以用铝或钢制造。已知铁在潮湿的空气中会迅速腐蚀,而铝不会。请解释铝耐腐蚀的原因。_______________________________________
(6)根据表中数据,描述用铝来取钢制造汽车车身的一项优点和一项缺点。
优点:_____________________________________________________________________
缺点:_____________________________________________________________________